
1.关于中国姓氏起源,唐人柳芳说:“氏于国,则齐鲁秦吴;氏于谥,则文武成宣……氏于事,则巫乙匠陶。”宋、陈、许等姓氏应源自
A.族号 B.邑号 C.爵号 D.行业
1.溶液的酸碱性与c(H+)、c(OH-)的关系:
a.溶液中c(H+)>c(OH-),且c(H+)>10-7mol·L-1时,溶液显酸性。
b.溶液中c(OH-)>c(H+),且c(OH-)>10-7mol·L-1时,溶液显碱性。
c.溶液中c(H+)=c(OH-)=1×10-7mol·L-1时,溶液显中性。
d.无论在什么溶液中,水电离出的H+浓度总等于水电离出的OH-浓度。
2.影响水的电离的因素
a.升高温度,促进水的电离,水的离子积增大。
b.加入酸或碱,抑制水的电离,Kw不变。
 H2O+H2O H3O++OH-
H2O+H2O H3O++OH-
 简写为:H2O H++OH-
简写为:H2O H++OH-
1.水的离子积常数
Kw=c(H+)·c(OH-)叫水的离子积常数,简称水的离子积。25℃时,Kw=1×10-14
3.c(H+)=1×10-7mol·L-1 c(OH-)=1×10-7mol·L-1
[讨论]从以上练习可以看出,溶液的酸碱性与溶液中的H+、OH-浓度有何关系?在酸、碱或盐溶液中,水电离出的H+、OH-浓度有何关系?
[学生讨论后得出结论,指定学生回答,并由其他同学补充,最后教师总结]
[板书]a.溶液中c(H+)>c(OH-),且c(H+)>10-7mol·L-1时,溶液显酸性。
b.溶液中,c(OH+)>c(H+),且c(OH-)>10-7mol·L-1时,溶液显碱性。
c.溶液中,c(OH-)=c(H+)=1×10-7mol·L-1时,呈中性。
d.无论在什么溶液中,水电离出的H+浓度总等于水电离出的OH-浓度。
[布置作业]课本习题一、1、2 三、1
●板书设计
第二节 水的电离和溶液的pH
2.c(H+)=0.2 mol·L-1 c(OH-)=5×10-14mol·L-1 c(OH-)水=5×10-14mol·L-1 c(H+)水=1×10-14mol·L-1
3. 0.1 mol·L-1的NaCl溶液中,c(H+)=? c(OH-)=?
[说明]在没有特别说明的情况下,水的离子积均指25℃的数值。
[答案]1.c(OH-)=0.1 mol·L-1 c(H+)=10-13mol·L-1 c(OH-)水=1×10-3mol·L-1
c(H+)水=1×10-13mol·L-1
2. 0.1 mol·L-1的H2SO4溶液中,c(H+)=? c(OH-)=? 由水电离出的c(OH-)水=? c(H+)水=?
[提问]什么样的物质才能发生电离?
[生]电解质。
[师]本节的标题为水的电离和溶液的pH,那么水是强电解质,还是弱电解质?
[生]弱电解质。
[师]弱电解质的电离有什么特点?
[指定学生回答,并由其他学生补充]
①不能完全电离;②电离过程可逆,存在电离平衡;③条件改变时,电离平衡发生移动。
[讲述]水的电离也具有以上特征,水中也存在着电离平衡。
 [板书]H2O+H2O H3O++OH-
[板书]H2O+H2O H3O++OH-
 简写为H2O H++OH-
简写为H2O H++OH-
[电脑模拟显示]水的电离平衡的建立。
[师]大家能根据水的密度求出纯水的浓度吗?请大家求一下是多少mol·L-1?
[学生活动]1000 g·L-1/18 g·mol-1=55.56 mol·L-1
[师]实验证明,25℃时,1升水中只有1×10-7mol的水分子发生电离,那么纯水电离出的H+及OH-浓度是多少呢?
[生]均为1×10-7mol·L-1
[师]可见水的电离程度是很小的。在一定温度时,c(H+)与c(OH-)的乘积是一个常数,通常我们把它写作KW,叫水的离子积常数。
[板书]1.水的离子积常数
Kw=c(H+)·c(OH-)叫水的离子积常数,简称水的离子积。
[问]已知25℃时,水电离出的H+和OH-浓度均为1×10-7mol·L-1,那么在该温度下,水的离子积常数为多少?
[生]1×10-14
[板书]25℃时,Kw=1×10-14
[讲述]虽然c(H+)和c(OH-)都有单位,但水的离子积常数是没有单位的,在计算时,注意别画蛇添足。
[问]影响弱电解质电离的因素有哪些?
[生]浓度、温度
[问]升高温度,水的电离平衡如何移动?
[生]升高温度,水的电离平衡正向移动,使c(H+)与c(OH-)均增大,因此水的离子积常数也随温度的升高而增大。
[师]指出:水的离子积只随温度的改变而改变,与浓度无关。下面请同学们根据我们学过的电离平衡知识讨论影响水的电离的因素有哪些?
[板书]2.影响水的电离的因素。
[投影]改变下列条件水的电离平衡是否移动?向哪个方向移动?水的离子积常数是否改变?是增大还是减小?
①升高温度 ②加入NaCl ③加NaOH ④加HCl
[学生讨论]
[答案]①平衡正向移动,离子积增大;②平衡不移动,离子积不变;③平衡逆向移动,离子积不变;④平衡逆向移动,离子积不变。
[小结并板书]a.升高温度,促进水的电离,水的离子积增大。
[讲述]实验证明,在100℃时,水的离子积为1×10-12
[板书]100℃时,Kw=1×10-12
b.加入某些盐,促进水的电离,Kw不变。
[提问]水中加入酸后,就成了酸溶液,此时溶液中还有OH-吗?
[生]有。
[过渡]既然酸溶液中有OH-,碱溶液中有H+,那么为什么溶液还有酸、碱之分呢?酸或碱溶液中的H+和OH-浓度之间有什么关系呢?下面我们学习第二个问题。
[板书]二、溶液的酸碱性和pH
1.溶液的酸碱性与c(H+)、c(OH-)的关系
[讲述]由于酸、碱或盐溶液中都同时存在着H+和OH-,而且水的离子积与浓度无关,在水中加酸时,水的电离平衡移动后,OH-浓度减小了,但溶液中H+浓度增大了,在水中加碱水中OH-浓度增大,H+浓度减小,但在酸或碱的稀溶液中,H+浓度和OH-浓度的乘积始终等于水的离子积,在25℃时,为1×10-14。
[师]请同学们讨论以下问题:
[投影]1. 0.1 mol·L-1的NaOH溶液中,c(OH-)=? c(H+)=? 由水电离出的c(OH-)水=? c(H+)水=?
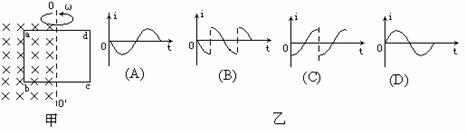
5、如图(甲)所示,单匝矩形线圈的一半放在具有理想边界的匀强磁场中,线圈轴线OO’与磁场边界重合。线圈按图示方向匀速转动。若从图示位置开始计时,并规定电流方向沿a→b→c→d→a为正方向,则线圈内感应电流随时间变化的图像是下图(乙)中的哪一个?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com