
5.定义在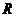 上的函数
上的函数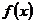 是奇函数又是以
是奇函数又是以 为周期的周期函数,则
为周期的周期函数,则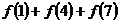 等于
等于
( )
A.-1
B.0  C.1
D.4
C.1
D.4
4.函数 的一个单调增区间为 ( )
的一个单调增区间为 ( )
A.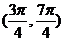 B.
B.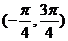 C.
C. D.
D.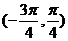
3.
曲线 在点P(1,2)处的切线方程是 ( )
在点P(1,2)处的切线方程是 ( )
A.
 B.
B.
C. D.
D.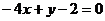
2.设函数 ,则
,则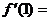 ( )
( )
A.
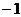 B. 0 C.1 D.4
B. 0 C.1 D.4
1.已知全集 ,集合
,集合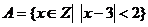 ,则集合
,则集合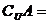 ( )
( )
A. {1, 2, 3, 4} B.{2, 3, 4} C.{1,5} D.{5}
4.Ⅰ.(10分)在下图中横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的质量:从A~D中选择符合表中各项要求的图象序号,填入相应的位置。


|
编号 |
溶 液 |
加入的物质 |
图象序号 |
|
① |
饱和石灰水溶液 |
通入过量CO2 |
|
|
② |
含少量NaOH的NaAlO2溶液 |
通入过量CO2 |
|
|
③ |
含少量NaOH的NaAlO2溶液 |
滴入稀盐酸 |
|
|
④ |
MgCl2、AlCl3混合溶液 |
逐滴加NaOH溶液至过量 |
|
|
⑤ |
 NaOH溶液 NaOH溶液 |
逐滴加AlCl3溶液至过量 |
|
24 还原 还原 氧化 还原 氧化 氧化 CO2 Fe[
25 Fe
FeCl2 H2 FeCl3 Fe(OH)2  Fe(OH)3 方程式
略
Fe(OH)3 方程式
略
26 Fe NaOH NaCl 方程式 略
27 2Al+6HCl=2AlCl3+6H2
略
Ⅰ.(10分)①B ②C ③D ④A ⑤C
27、(10分)下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金 属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
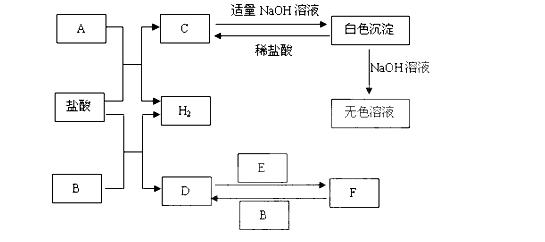
试回答下列问题:
(1)写出A与盐酸反应的离子方程式

 。
。
(2)写出反应F→D的离子方程式是 。
(3)写出反应D→F的离子方程式是 。
(4)检验F中金属阳离子的常用试剂是 。
(5)工业上冶炼金属A的化学方程式是

26、(10分)已知A是一种常见金属,C是强碱,各物质有以下物质相互转化。试回答:
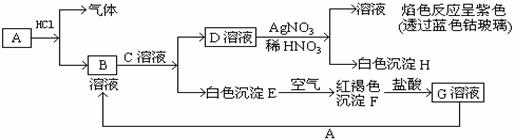
(1)写出A的化学式 ,C的化学式 D的化学式
(2)写出由D转变成H的化学方程式 。
(3)写出向G溶液加入A的离子反应方程式 ________。
25、(14分)金属单质A与盐酸反应生成浅绿色溶液B,同时放出气体C。如果在B溶液中通入氯气,则B转变成棕黄色溶液D,将溶液D分为两份,一份加入几滴硫氰化钾溶液,生成红色物质,另一份加入A,则棕黄色溶液D重新变成浅绿色溶液B,在溶液B中滴加NaOH溶液生成白色沉淀E,露置在空气中,会逐渐变成红褐色沉淀F。则各物质的化学式分别是:
A B C D E F
有关反应的离子方程式有:
① B转变D
② D加A
② B生成E
④ E生成F
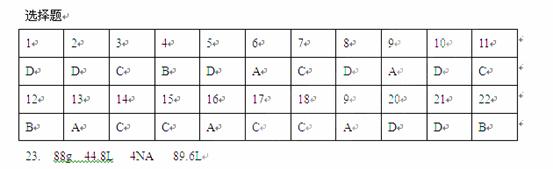
24.(8分)已知CO和Fe2O3在高温下发生反应:3CO + Fe2O3 = 2Fe + 3CO2 ,
其中Fe2O3被_____________(填“氧化”或“还原”),发生__________反应,是_______剂。CO是____________剂,被_______________,发生__________反应。氧化产物是_______还原产物是 ________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com