
22.某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。 请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 NH4+ 和 Fe2+ ,阴离子是 SO42- 。
(2)试通过计算确定该结晶水合物的化学式为 (NH4)2Fe(SO42-)2.6H2O 。
21、实验证明,以下六种物质是一个氧化还原反应的反应物和生成物:
NO、FeSO4、H2O、Fe(NO3)3、HNO3、Fe2(SO4)3。
⑴请将上述物质填在横线上组成一个化学方程式并配平该化学方程式:
 HNO3+
HNO3+ FeSO4
FeSO4 
 Fe2(SO4)3 +
Fe2(SO4)3 + Fe(NO3)3+
Fe(NO3)3+ NO +
NO + H2O
H2O


 ⑵反应中作还原剂的物质是FeSO4 (填化学式),被氧化的元素是 Fe ;
⑵反应中作还原剂的物质是FeSO4 (填化学式),被氧化的元素是 Fe ;
⑶发生还原反应的物质是 HNO3 (填化学式);
⑷若有0.6mol的还原剂完全反应时,上述化学反应转移的电子的物质的量是 0.6 mol 。
20.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g· cm-3,质量分数为w,物质的量浓度为c mol/L,溶液中含氢氧化钠质量为m g。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为__100w/1-w___。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为__1000m/40v____。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为1000dw/40____。
(4)用c、d表示溶液中溶质的质量分数(w)为__40c/1000d____。
18. A、B、C、D四种可溶性盐,它们的阳离子可能是Ba2+、Ag+、K+、Fe2+,阴离子可能是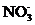 、
、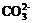 、Br-、
、Br-、 ,彼此不重复。进行如下实验:
,彼此不重复。进行如下实验:
(1) 将四种盐分别配成少量溶液,其中呈现淡绿色的只有B盐溶液;
(2) 向上述溶液中分别加入盐酸,C盐溶液中有沉淀生成,A盐溶液中有无色无味的气体逸出。
试确定:A是 K2CO3 ,B是 FeSO4 ,C是 AgNO3 ,D是 BaBr2 。
19 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。③检查装置气密性。④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
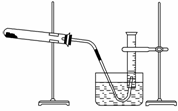
回答下列问题:
(1)如何检查装置的气密性?_用手握住试管,如果插入水中的导管口有气泡说明气密性好_。
(2)以下是测量收集到气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:_②__①____③__(请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?
答:_上下移动量简使量筒内外液面的高度相同___。
(4)如果实验中得到的氧气体积是c L(换算为标准状况下后),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)=(a-b)22.4/c__。
17.为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。
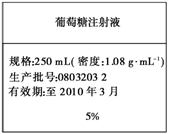
实验用品:葡萄糖晶体(摩尔质量:180 g·mol-1)、蒸馏水、烧杯、容量瓶(500 mL)、药匙、胶头滴管、量筒。
(1)还缺少的仪器有 天平,玻璃棒 。
(2)下列对容量瓶及其使用方法的描述中正确的是__A____。
A.使用前要检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗
C.配制溶液时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1-2 cm处,改用胶头滴管加蒸馏水至刻度线
D.容量瓶上标有体积、温度和浓度
(3)实验中需取用晶体的质量为____27____g,物质的量浓度__0.3 mol/L ______。
16.在三个密闭容器中分别充入N2、H2、O2三种气体,在以下各种情况下排序正确的是
A.当它们的体积和温度、压强均相同时,三种气体的密度ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强p(H2)>p(N2)>p(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量m(H2)>m(N2)>m(O2)
耒阳一中高三第一轮复习第一次月考化学答卷
15.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol·L-1
14.M(NO3)2热分解化学方程式为:2 M(NO3)2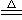 2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
A.148g/mol B.24g/mol C.65g/mol D.40g/mol
13.若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7:4
12、下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2+2OH-===SO32 -+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+ === 2Mn2++5NO3- +3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO3- +Ba2++2OH-===BaCO3↓+2H2O+CO32 -
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com