
1.钱穆在《中国历代政治得失》中指出:“论中国政治制度,秦汉是一个大变动。唐之于汉,也是一大变动。但宋之于唐,却不能说有什么大变动,一切因循承袭。有变动的,只是迫于时代,迫于外面一切形势,改头换面,添注涂改地在变。”材料中两次“大变动”分别指的是 ( )
A.分封制、宗法制 B.三公九卿制、三省六部制
C.郡县制、行省制 D.三省六部制、内阁制
12、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g) △H=-24.8kJ/mol
Fe203(s)+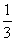 CO(g)==
CO(g)== 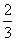 Fe3O4(s)+
Fe3O4(s)+ 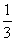 C02(g)
△H=-15.73kJ/mol
C02(g)
△H=-15.73kJ/mol
Fe304(s)+CO(g)==3FeO(s)+C02(g) △H=+640.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:

版权所有:()
版权所有:()

11、(1)1g碳与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94KJ热量,此反应的热化学方程式为__________________________________________。
(2)奥运会圣火燃料中成份之一是丙烷,标准状况下4.48L丙烷完全燃烧生成二氧化碳和液态水时放出150.1 kJ的热量,则丙烷燃烧的热化学方程式中为____________________。
(3)家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧反应的热化学方程式 。已知1 mol液态水汽化时需要吸收44 kJ的热量,则1 mol丁烷完全燃烧并生成气态水时放出的热量为 kJ。
10.已知两个热化学方程式: C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )A.1:1 B.1:2 C.2:3 D.3:2
9.已知热化学方程式:2SO2(g)+
O2(g) 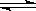 2SO3(g) △H = ―196.64kJ/mol,在容器
2SO3(g) △H = ―196.64kJ/mol,在容器
中充入8molSO2和1molO2充分反应,最终放出的热量为 ( )
A.196.64kJ B.<98.32kJ/mol C.<196.64kJ D.>196.64kJ
8.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-89.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最多的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
7、已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
常温下,取体积比为2:3的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少kJ( )
A.0.2Q1+0.15Q3 B.0.4Q1+0.05Q2 C.0.4Q1+0.1Q3 D.0.4Q1+0.1Q2
6、已知:(l)H2(g)+1/2 O2(g)
=H2O(g) △H1=a kJ·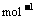
(2)2H2(g)+O2(g)
=2H2O(g) △H2=b kJ·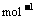
(3)H2(g)+1/2 O2(g)=H2O(l) △H3=c kJ·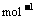
(4)2H2(g)+O2(g)
=2H2O(l) △H4=d kJ·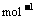
下列关系式中正确的是( )A.a<c<0 B.b>d>0 C.b=2a<0 D.d=2c>0
5、已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g) △H= -393.51kJ·mol–1
C(金刚石)+O2(g)=CO2(g) △H= -395.41kJ·mol–1
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应,石墨比金刚石稳定
B.由石墨制备金刚石是吸热反应,金刚石比石墨稳定
C.由石墨制备金刚石是放热反应,石墨比金刚石稳定
D.由石墨制备金刚石是放热反应,金刚石比石墨稳定
4、2008年北京奥运会“祥云”火炬用的环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用
燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5kJ·mol-1,下列有关说
法正确的是( )
A.丙烷燃烧的热化学方程式:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ·mol-1
B.奥运火炬燃烧主要是将化学能转变为热能和光能
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷的沸点比丁烷高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com