
6、铵盐的重要性质:
都是晶体,易溶于水,是重要的化肥,如 、NH4NO3、(NH4)2SO4、NH4HCO3等。
、NH4NO3、(NH4)2SO4、NH4HCO3等。
①受热分解:
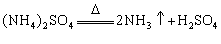
②与碱反应:  (检验铵离子)
(检验铵离子)
例2 缓慢地把空气通入盛浓氨水的锥形瓶,再把红热的螺旋状铂丝接触液面,观察到的现象是 ,有关的化学方程式为:
① ②
③ ④
练习题:
5、氨气的检验:
使湿润的红色石蕊试纸变蓝及酚酞试纸变红。离子方程式:
4、氨气的实验室制法:
(1)原理:
(2)装置:∵固+固 气
气
∴使用大试管、单孔胶塞、导管、酒精灯、铁架台等。
(3)干燥:使用 ,不能用CaCl2
(4)收集:∵NH3极易溶于水,比空气轻
∴用 排空气法。
3、氨气的化学性质:
(1)与水反应:




氨水中含的分子和离子有:
氨水中的溶质仍是氨分子。
例1将11.2升(标况)氨气溶于91.5g水中,此氨水的质量分数为多少?若溶液密度为1g/cm3,摩尔浓度为多少?
(2)与酸反应生成铵盐:
NH3+HCl=NH4Cl
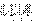 结构式为 ,电子式为
结构式为 ,电子式为
实验测得:四个键的键能、键长、键角都是相同的,所以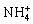 为 体构型。
为 体构型。
(3)具有还原性: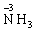 方程式举例:
方程式举例:
2、氨气的物理性质:
无色有刺激性气味的气体,容易液化,极易溶于水。
1、氨的分子结构:电子式: ,结构式: ,空间构型:
3.(1)浓氨水和浓硝酸 (2)浓氨水和浓硫酸 (3)浓氨水和浓盐酸 (4)氢气在氯气中燃烧 (5)铜在氯气中燃烧能产生白烟的是_______________。
[作业]家庭作业:
课堂作业:3,4,5,6(课堂处理选择题)___________________________
4,硫酸铵分解生成氮气,二氧化硫和水则氧化产物和还原产物的物质的量之比为__________;硝酸铵按下式分解:NH4NO3=N2+H2O+HNO3,其氧化产物的物质的量之比为_________。5,(1)浓氨水和浓硝酸(2)浓氨水和浓硫酸(3)浓氨水和浓盐酸(4)氢气在氯气中燃烧(5)铜在氯气中燃烧能产生白烟的是____________。
氨 铵盐(第二课时)
2.硫酸铵分解生成氮气,二氧化硫和水则氧化产物和还原产物的物质的量之比为_______;硝酸铵按下式分解:NH4NO3=N2+H2O+HNO3,其氧化产物的物质的量之比为_______。
1.碳酸铵完全分解维持产物为气态,其平均分子量是________________。
4.硝酸铵受热分解(较复杂,教师讲解)
(硝酸铵受热以发生爆炸,硝铵能作为炸药的原料)
[板]结论:挥发性的酸的铵盐受热分解,生成相应的酸与氨气(氯化铵,碳酸氢铵,亚硫酸铵)
不挥发性酸的铵盐受热时生成酸式盐与氨气(磷酸铵)
氧化性酸的铵盐受热时,发生氧化还原反应,通常生成氮气,即氨被氧化。(硫酸铵,硝酸铵,亚硝酸铵)
[讲]亚硝酸铵受热分解生成氮气,这是实验室制取氮气的方法(将氯化铵与亚硝酸钠的混和溶液加热,即可制取氮气。
NaNO2+NH4Cl=NH4NO2+NaCl NH4NO2=N2+2H2O
[板]2、铵盐与碱反应
[讲]铵盐都能与碱反应生成氨气,实验室制取氨气时就是利用这一反应原理。这是一切铵盐的共同性质。
[生板]写出下列反应的离子方程式
(1)碳酸氢铵溶液和氢氧化钠溶液 (2)氯化铵溶液与澄清石灰水
(3)硫酸铵溶液与氢氧化钡溶液 (4)硫酸铵溶液与烧碱溶液反应
[讲]上述反应原理也能用于铵离子的检验。
[讲]铵盐的用途。
[练习]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com