
9、某电解池内盛有硫酸铜溶液,插入两根电极,通电后欲达到下列要求:①阳极质量不变;②阴极质量增加;③电解后溶液pH变小。则可选用的电极是( )
A.石墨做阴极和阳极 B.铜做阳极,铁做阴极
C.铁做阳极,铜做阴极 D.铜做作阳极,铂做阴极
8、 pH= a某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
7、用惰性电极实现电解,下列说法正确的是( )
A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
6、一个电池的总反应:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
A. B. C. D.
正极 Zn Cu Cu Ag
负极 Cu Zn Zn Cu
电解质溶液 CuCl2 H2SO4 CuSO4 AgNO3
5、人造地球卫星用到的一种高能电池--银锌蓄电池,它在放电时的电极反应为:Zn + 2OH– –2e–=ZnO + H2O,Ag2O + H2O + 2e–=2Ag + 2OH–,下列叙述中,正确的是( )
A、Ag2O 是负极,并被氧化 B、电流由锌经外电路流向氧化银
C、工作时,负极区溶液pH减小,正极区pH增大
D、溶液中OH-向正极移动,K+、H+向负极移动
4、原电池的电极反应不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确是( )
A、由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e- =Al3+
B、由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Mg-2e-=Mg2+
C、由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-=Fe2+
D、由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
3、锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为:Li+MnO2==LiMnO2,下列关于该锂的电池说法中,正确的是( )
A、Li是正极,电极反应为Li-e- == Li+ B、Li是负极,电极反应为Li-e-== Li+
C、Li是负极,电极反应为MnO2 + e- == MnO2- D、Li是负极,电极反应为Li-2e- == Li2+
2、关于如右图所示装置的叙述中,正确的是( )
A、铜是阳极,铜片上有气泡产生 B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片 D、氢离子在铜片表面被还原
1、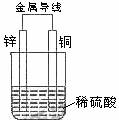 铜片和银片用导线连接后插入某氯化钠溶液中,铜片是( )
铜片和银片用导线连接后插入某氯化钠溶液中,铜片是( )
A、阴极 B、正极 C、阳极 D、负极
5.速率与平衡的图象分析
主要要抓住三点,即起点、拐点和终点。
经典题:
例题1:(2001年全国高考)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是 ( )
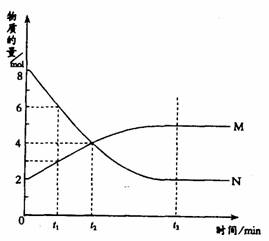
A.反应的化学方程式为:2M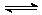 N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
方法:图象分析法。
捷径:从图中得到N为反应物,M为生成物。从0→t2min,M增加2mol,N消耗4mol,且到达t3min,M、N的浓度保持不变,即反应为可逆反应,反应式为 。t2时反应物和生成物物质的量相等,此时不是正、逆反应速率相等。当t3时正逆反应的速率相等。t1时n(N)=6mol,n(M)=3mol,由于在同一容器中,所以c(N)=2c(M)。因此此题正确答案为D。
。t2时反应物和生成物物质的量相等,此时不是正、逆反应速率相等。当t3时正逆反应的速率相等。t1时n(N)=6mol,n(M)=3mol,由于在同一容器中,所以c(N)=2c(M)。因此此题正确答案为D。
总结:选项B最容易被误认为正确说法。造成错判的原因有三:①没有看清纵坐标的物理量;②概念错误,认为物质的量相等时,化学反应速率就相等;③没有读懂图。
例题2 :(1998年全国高考)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应: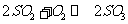 ,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率 ( )
,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率 ( )
A.等于p% B.大于p% C.小于p% D.无法判断
方法:平衡中的等效转化分析法。
捷径:设乙容器压强保持1.01×105Pa,因甲容器中体积保持不变,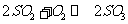 的正反应是个气体体积缩小的反应,达到平衡时,混合气体的总压强小于1.01×105Pa。又减小压强,平衡向逆反应方向移动,则甲容器中SO2转化率低,乙容器中(定压)SO2的转化率高。以此得答案为B。
的正反应是个气体体积缩小的反应,达到平衡时,混合气体的总压强小于1.01×105Pa。又减小压强,平衡向逆反应方向移动,则甲容器中SO2转化率低,乙容器中(定压)SO2的转化率高。以此得答案为B。
总结:将两平衡态先相联系,再依据平衡移动原理相互转化,便能快速方便获得结果。
例题3 :(2002年全国高考)在一定温度下,向a L密闭容器中加入1 mol X气体和2mol
Y气体,发生如下反应: 。
。
此反应达到平衡的标志是 ( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为l : 2 : 2
D.单位时间消耗0.1 mol X的同时生成0.2 mol Z
方法:从平衡状态下正逆反应速率相等分析。
捷径:此反应为一气体分子数减小的反应,故容器内压强不随时间变化,说明巳达平衡。各物质的浓度不随时间变化而变化,说明正逆反应速率相等,巳达平衡状态。浓度为一固定比值不能说明巳达平衡。D项中的所述均为正反应,未提到逆反应,故不能判断。以此得答案为AB。
总结:平衡状态的判断,是高考中的重点内容,也是平衡中的重点。此类试题只要抓住平衡状态下速率相等,各成分的百分含量保持不变,即可求解。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com