
12.(2007北京卷)(17分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是
。
11.(2006年江苏)(5分)把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计).
求:(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
10.(2006年江苏卷)(10分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液的pH=8-9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH较难控制,可改用____________________。
9. (2005年江苏)下图中,A、C是工业上上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
(2005年江苏)下图中,A、C是工业上上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:
(1)写出B的化学式 ,G的电子式 。
(2)反应①的离子方程式 ;
(3)反应②进行的条件是 , ;
(4)反应③的化学方程式为 。
8、(2005年北京春) (12分)为确定某铝热剂(含氧化铁和铝)的组成,分别进行
下列实验。(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。
反应的化学方程式是__________________________.
样品中铝的质量是_____________g
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_____________,氧化铁与铝的质量比是_____________.
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b=_____________.
7.(2004全国)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·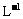 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_______________________,产物中的单质B是______________。
(2)②中所发生的各反应的化学方程式是____________________________________
_________________________________________________________。
(3)③中所发生的各反应的离子方程式是_____________________________ _____
_________________________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为___________________,
c(Fe2+)为____________________________________________________。
6、(2008年广东卷)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
5.(2006年江苏)向一定量的下列物质的溶液中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解.这种物质是( )
A.MgS04 B.NaAl02 C.A1C13 D.FeCl3
4.(2005年江苏)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 高温 2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
3.(2004年全国)若1.8g某金属跟足量盐酸充分反应,放出2.24L(标准状况)氢气,则该金属是( )
A.Al B.Mg C.Fe D.Zn
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com