
2.两条关系式
|
反应物 |
反应中化合价变化 |
反应中电子的得失 |
反应物具有的性质 |
反应中反应物自身的变化 |
反应后的生成物 |
|
氧化剂 |
降低 |
得到 |
氧化性 |
被还原 |
还原产物 |
|
还原剂 |
升高 |
失去 |
还原性 |
被氧化 |
氧化产物 |
1.氧化还原反应的实质:是电子的转移;氧化还原反应的特征表现:是元素化合价的变化。
6.AgBr、AgI的感光性
它们都见光分解,AgBr用于感光底片的感光材料;AgI用于人工降雨。
5.Cl-、Br-、I-的检验
(1)AgNO3─HNO3法
|
离子 |
选用试剂 |
实验现象及离子方程式 |
|
Cl- |
AgNO3的稀HNO3溶液 |
Ag+ + Cl- == AgCl↓ 白色沉淀 |
|
Br- |
AgNO3的稀HNO3溶液 |
Ag+ + Br- ==
AgBr↓ 浅黄色沉淀 |
|
I- |
AgNO3的稀HNO3溶液 |
Ag+ + I- ==
AgI↓ 黄色沉淀 |
(2)Br- 、I- 可以用氯水反应后加 CCl4 萃取的方法。
4.Cl2、Br2、I2的化学性质的比较
⑴与金属反应
2Na + Cl2 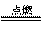 2NaCl,
2NaCl,
Cu + Cl2  CuCl2,
CuCl2,
2Fe + 3Cl2 2FeCl3,
2FeCl3,
2Fe + 3Br2  2FeBr3,
2FeBr3,
Fe + I2  FeI2。
FeI2。
⑵与氢气反应
|
反应物 |
反应方程式 |
反应条件 |
反应现象 |
|
H2与F2 |
H2 + F2 == 2HF |
冷、暗 |
爆炸 |
|
H2与Cl2 |
H2 + Cl2=2HCl |
光照 |
爆炸 |
|
H2与Br2 |
H2 + Br2=2HBr |
加热 |
反应 |
|
H2与I2 |
H2 + I2  2HI 2HI |
持续加热 |
可逆反应 |
⑶与水的反应
2F2 + 2H2O == 4HF + O2
X2
+ H2O  HX
+ HXO (X:Cl、Br、I)
HX
+ HXO (X:Cl、Br、I)
⑷与碱反应
Cl2、Br2、I2都容易与碱液反应,常用于除尾气、除杂质等。工业上利用这反应来制漂白粉,反应式是:2Cl2 + 2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O,漂白粉主要成分是CaCl2 + Ca(ClO)2 ,有效成分是Ca(ClO)2 。
⑸Cl2、Br2、I2相互置换
氧化性Cl2>Br2>I2,所以Cl2可以将Br2、I2置换出,Br2可以将I2置换出。
如:Cl2 +2NaBr == 2NaCl + Br2.
3.Cl2、Br2、I2在不同溶剂中的颜色比较
|
|
水 |
酒精 |
苯 |
汽油 |
四氯化碳 |
|
Cl2 |
黄绿色(新制) |
黄绿色 |
黄绿色 |
黄绿色 |
黄绿色 |
|
Br2 |
黄―橙 |
橙―橙红 |
橙―橙红 |
橙―橙红 |
橙―橙红 |
|
I2 |
深黄 ―褐色 |
棕―深棕 |
浅紫 ―紫 |
紫―深紫 |
浅紫红-紫红 |
2.Cl2、Br2、I2的物理性质的比较
|
气体 |
物理性质 |
|
Cl2 |
黄绿色有刺激性气味的有毒气体,能溶于水(1:2),易液化,密度比空气大 |
|
Br2 |
深红棕色液体,易挥发,有刺激性气味,有毒,在水中溶解度不大,但在有机溶剂中溶解度较大,储存时要加水,水封,以防止挥发 |
|
I2 |
紫黑色固体,有光泽,易升华,在水中溶解度不大,但在有机溶剂中溶解度较大 |
1.氯气的制法
(1)氯气的工业制法
原料:氯化钠、水。原理:电解饱和食盐水。
装置:阳离子隔膜电解槽。
反应式:2NaCl + 2H2O
 2NaOH + H2 ↑+ Cl2↑
2NaOH + H2 ↑+ Cl2↑
(2)氯气的实验室制法
原理:利用氧化剂氧化浓盐酸中的Cl-。常用的氧化剂有:MnO2、KMnO4、KClO3等。
反应式:MnO2
+ 4HCl(浓) MnCl2
+ Cl2↑+
2H2O
MnCl2
+ Cl2↑+
2H2O
2KMnO4 + 16HCl(浓) =2KCl + 2MnCl2 + 10Cl2↑+ 8H2O
KClO3 + 6HCl(浓) == KCl + 3Cl2↑+ 3H2O
装置:发生装置由圆底烧瓶、分液漏斗、双孔塞、导管、铁架台、石棉网、酒精灯等组成。
收集:用向上排空气法或用排饱和食盐水或排饱和氯水的方法。
验满:看颜色或用湿润的淀粉碘化钾试纸。尾气吸收:用氢氧化钠溶液吸收。
除杂:用饱和食盐水除去HCl 杂质; 干燥:用浓H2SO4 。
(3)中学实验室制H2、O2、Cl2的发生装置的比较
|
气体 |
反应物的状态 |
反应条件 |
装置或主要仪器 |
可适用的气体 |
|
H2 |
固体和液体反应 |
不加热 |
启普发生器或简易装置 |
H2S、CO2、SO2等 |
|
O2 |
固体或固体混合物 |
加热 |
大试管、铁架台、导管等 |
NH3、CH4等 |
|
Cl2 |
固体和液体或液体和液体 |
加热 |
圆底烧瓶、分液漏斗、双孔塞、导管、铁架台、石棉网、酒精灯 |
HCl、HBr、HI等 |
15. (2005浙江省高考理综)已知Q与R的式量之比为9:22,在反应X+2Y=2Q+R中,当1.6 gX与Y完全反应后,生成4.4 g R,求参与反应的Y和生成物Q的质量之比。
14. 已知1个N2O3分子的质量为akg,1个N2O5分子的质量为bkg,若以1个氧原子(16O)质量的1/16作为相对原子质量的标准,则NO2的式量为_______________。
已知1个N2O3分子的质量为akg,1个N2O5分子的质量为bkg,若以1个氧原子(16O)质量的1/16作为相对原子质量的标准,则NO2的式量为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com