
2.物理性质:①状态: ;②熔.沸: ;③硬度: ;④水溶性 。
1.存在:二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。
天然二氧化硅的矿物有:硅石、水晶、石英、玛瑙、石英砂等。
3. 硅的制备
工业上用炭自在高温下还原二氧化硅的方法,制得含有少量杂质的粗硅。将粗硅在高温下跟氯气气反应生成四氯化硅,四氯化硅经提纯后,再用氢气还原,就可以得到高纯度的硅。
|
(1) SiO2+ C―― (制粗硅)
 (2) Si+ Cl2――
(分馏、提纯)
(2) Si+ Cl2――
(分馏、提纯)
 (3) SiCl4+ H2―― + (制纯硅)
(3) SiCl4+ H2―― + (制纯硅)
2.化学性质:很稳定
 (1)常温下不与O2、Cl2、H2、浓H2SO4、浓HNO3等反应。
(1)常温下不与O2、Cl2、H2、浓H2SO4、浓HNO3等反应。
 (2)加热或高温时有强还原性:
(2)加热或高温时有强还原性:
 Si+ O2――
Si+ O2――
 Si+ C――
Si+ C――
Si+ Cl2――
(3)常温下能与氟气(F2)、氢氟酸(HF)反应:
Si十 F2――
Si十 HF――
1.物理性质:晶体硅是 色、有金属光泽、硬而脆的固体,熔点和沸点都很 ,硬度也很大(因为它的结构类似于金刚石),是良好的 材料,广泛应用于电子的各个领域。
3. 硅酸盐产品(传统材料)
水泥:
 生产原料:有黏士(主要成分为硅酸盐),石灰石。
生产原料:有黏士(主要成分为硅酸盐),石灰石。
设备:水泥回转窑(高温煅烧)。
石膏:调节水泥的硬化速率。
普通玻璃:
 生产的原料:石英、纯碱、石灰石
生产的原料:石英、纯碱、石灰石
设备:玻璃熔炉(高温熔融)
制玻璃的主要反应:SiO2
+ Na2CO3 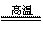 Na2SiO3 + CO2↑,SiO2 + CaCO3
Na2SiO3 + CO2↑,SiO2 + CaCO3
 CaSiO3 + CO2↑.
CaSiO3 + CO2↑.
陶瓷:
主要原料:粘土、石英砂
[典题解悟]
[例1]熔融烧碱应选用的器皿是( )
A.石英坩埚 B.普通玻璃坩埚
C.生铁坩埚 D.陶瓷坩埚
解析:石英、普通玻璃、陶瓷中均含有SiO2,高温下,烧碱能与SiO2反应而使坩埚腐蚀:SiO2+2NaOH Na2SiO3+H2O,铁在高温下不与NaOH反应。
Na2SiO3+H2O,铁在高温下不与NaOH反应。
答案:C
点评:实验中选用器皿,既要考虑器皿材料的熔点,又要考虑材料与所盛物质之间能否反应。
[例2]高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是( )
A.7、2 B.5、4 C.6、3 D.3、6
解析:解答此题涉及两个未知数x、y,但由化合价规则只能列出一个方程,因而本题要用解不定方程的知识。根据化合价规则,Al为+3价,Si为+4价,O为-2价,OH为-1价,则有
2×(+3)+2×(+4)+x×(-2)+y×(-1)=0,化简得2x+y=14,将A-D中x、y值代入,只有B项符合方程。
答案:B
点评:由于该化合物中各元素无变价,很容易根据化合物中各元素(或原子团)化合价代数和为零建立不定方程。
 [例3]三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁Mg2Si3O8·nH2O改写成氧化物的形式为______,它中和胃酸(HCl)的化学方程式是_________________________。
[例3]三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁Mg2Si3O8·nH2O改写成氧化物的形式为______,它中和胃酸(HCl)的化学方程式是_________________________。
 解析:本题若直接写三硅酸镁与盐酸的反应,很多学生会感到无从入手或写错方程式。但若能将此硅酸盐改写成氧化物的形式,便可看出该反应可看作是判断碱性氧化物(MgO)、酸性氧化物(SiO2)能否与盐酸反应的问题。
解析:本题若直接写三硅酸镁与盐酸的反应,很多学生会感到无从入手或写错方程式。但若能将此硅酸盐改写成氧化物的形式,便可看出该反应可看作是判断碱性氧化物(MgO)、酸性氧化物(SiO2)能否与盐酸反应的问题。
答案:2MgO·3SiO2·nH2O;
2MgO·3SiO2·nH2O+4HCl 2MgCl2+3SiO2+(n+2)H2O。
2MgCl2+3SiO2+(n+2)H2O。
点评:解题依据是:碱性氧化物与酸反应生成盐和水,酸性氧化物不与酸(盐酸)反应。
[当堂检测]
[课堂练习1]给下列溶液中通入CO2气体,不可能产生沉淀的是 ( )
(A)氯化钙和硝酸钡的混合液 (B)稀的水玻璃
(C)偏铝酸钠溶液 (D)碳酸钠饱和溶液
[课堂练习2]在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是 ( )
(A)生石灰 (B)石灰石 (C)石英 (D)纯碱
[课堂练习3] 应用带胶塞的玻璃试剂瓶保存的溶液是 ( )
(A)烧碱 (B)硫酸钠溶液 (C)水玻璃 (D)浓硫酸
[课堂练习4] 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2
+ 3C
 2AlN + 3CO
2AlN + 3CO
下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2molAlN,N失去6mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝是铝合金中的一种
[课堂练习5]下列物质属于纯净物的是 ①水玻璃 ②水泥 ③玻璃 ④漂白粉 ⑤胆矾 ⑥氯水 ⑦液氯 ( )
A. ①④ B. ①⑤ C. ①⑤⑥ D. ⑤⑦
 [课堂练习6]氢氧化铝胶囊、碳酸氢钠粉剂都因能同胃酸反应,曾用来治疗胃酸过多。三硅酸镁(2MgO·3SiO2·nH2O)和氢氧化铝胶囊一样,在治疗时作用更持久。试写出三硅酸镁同胃酸的主要成分作用的离子方程式:
。
[课堂练习6]氢氧化铝胶囊、碳酸氢钠粉剂都因能同胃酸反应,曾用来治疗胃酸过多。三硅酸镁(2MgO·3SiO2·nH2O)和氢氧化铝胶囊一样,在治疗时作用更持久。试写出三硅酸镁同胃酸的主要成分作用的离子方程式:
。
 2MgO·3SiO2·nH2O+4H+
2MgO·3SiO2·nH2O+4H+ 2Mg2++3SiO2+(n+2)H2O。
2Mg2++3SiO2+(n+2)H2O。
2.Na2SiO3的性质:Na2SiO3易溶于水,水溶液俗称“水玻璃”。
化学性质:(1)水溶液呈碱性(用PH试纸测),通CO2有白色沉淀:Na2SiO3 + CO2 +2 H2O == Na2CO3 + H4SiO4↓(原硅酸,白色胶状沉淀),离子方程式:SiO32- + CO2 +2 H2O == CO32- + H4SiO4↓。
原硅酸不稳定,易失水成硅酸:H4SiO4 == H2SiO3 + H2O(硅酸在方程式中可代替原硅酸书写。)
硅酸受热分解:H2SiO3
 H2O + SiO2 ,
H2O + SiO2 ,
原硅酸和硅酸都是难溶于水的弱酸,酸性:H2CO3强于H4SiO4或H2SiO3。
(2)硅酸钠溶液中滴加稀盐酸有白色沉淀:
Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓,
离子方程式:SiO32- + 2H+ == H2SiO3↓.
(3)硅酸和氢氧化钠反应:H2SiO3 + 2NaOH == Na2SiO3 + 2H2O.
离子方程式:H2SiO3 + 2OH- ==SiO32- +2H2O 。
1.硅酸盐的结构:
(1)硅酸盐的结构复杂,常用氧化物的形式表示比较方便。硅酸盐结构稳定,在自然界中稳定存在。
(2)氧化物形式书写的规律:
①各元素写成相应的氧化物,元素的价态保持不变。
②顺序按先金属后非金属,金属元素中按金属活动顺序表依次排列,中间用“•”间隔。
③注意改写后应与原来化学式中的原子个数比不变。
2、铜的冶炼
工业上是高温冶炼黄铜矿得到粗铜,然后用电解方法精练得到纯度很高的精铜,电解中将粗铜连在电源的正极,精铜连在电源的负极,用可溶性的铜盐做电解液。这样通电一段时间后,粗铜上的铜就不断溶下,在精铜表面析出。
1、铜的性质
(1)物理性质
铜是紫红色的金属,是电和热的良导体,广泛用作导线,密度8.9g/cm3。
(2)化学性质
铜是较不活泼的金属,自然界中有少量的单质铜存在,大部分是化合态如黄铜矿(CuFeS2),孔雀石(CuCO3·Cu(OH)2)等。
铜在一定条件下可发生如下反应:
①与非金属单质反应:2Cu + O2  2CuO(黑色),Cu + Cl2
2CuO(黑色),Cu + Cl2
 CuCl2(棕黄色的烟)
CuCl2(棕黄色的烟)
2Cu + S  Cu2S(黑色)
Cu2S(黑色)
②与某些盐溶液反应:Cu + 2FeCl3 == 2FeCl2 + CuCl2 ,Cu + 2AgNO3 == Ag + Cu(NO3)2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com