
1.预计到2010年,中国将成为仅次于美国的全球第二大市场,商品进口额约1.2万亿美元,服务商品进口额将超过2000亿美元,中国的国内市场规模接近5万亿美元。这些都将为全球贸易伙伴创造巨大的市场空间和难得的商机。这说明( )
①我国日益融入经济全球化的浪潮中
②我国进一步优化进出口结构
③经济全球化使中国与世界各国的经济联系日益密切
④经济全球化是以美国等发达资本主义国家为主导的
A.①② B.③④
C.②④ D.①③
解析:此题并没有涉及进出口结构的优化,因此,不选②。④虽然正确,[JP]但不符合题意,因此也不选。
答案:D
12.(2008年全国卷Ⅱ改编)红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)根据下图回答下列问题:
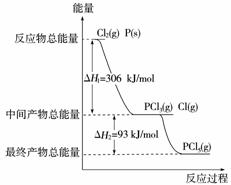
(1)P和Cl2反应生成PCl3的热化学方程式____________ ____________ ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式____________ ____________ ;
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________ ____________ ;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________;P和Cl2一步反应生成1 mol PCl5的ΔH4__________ΔH3(填“大于”,“小于”或“等于”);
(5)PCl5与足量水反应,最终生成两种酸,其化学方程式是____________ 。
11.(2009年苏州调研)A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知:A(s)+B(g)=C(g)+D(g);ΔH=+131.4 kJ·mo-1L,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
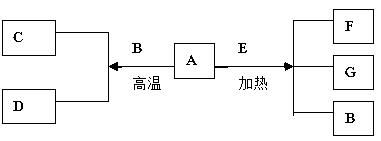
(1)写出A元素的名称____________。
(2)另外知:
A(s)+O2(g)=G(g);ΔH=-393.6 kJ·mo-1L
C(g)+1/2O2(g)=G(g);ΔH=-283 kJ·mo-1L
D(g)+1/2O2(g)=B(g);ΔH=-242 kJ·mo-1L
由此判断“因为283 kJ·mo-1L+242 kJ·mo-1L>393.6 kJ·mo-1L
,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?并说明理由____________ ____________ 。
(3)写出A+O2→C的热化学方程式:____________ 。
10.丙烷燃烧可以通过以下两种途径:

请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量____________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量____________(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要____________(填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是____________ 。
(3)b与a、c、d的数学关系式是____________ 。
9.近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是( )
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式为:
C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ·mo-1L
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 kJ·mo-1L
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是______________。
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、
TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式____________ 。
8.(2009年云浮质检)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g);ΔH1②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g);ΔH2③Sn(s,灰)[FY(KN]>13.2 ℃/<13.2 ℃Sn(s,白);ΔH3=+2.1 kJ·mo-1L下列说法正确的是( )
A.ΔH1<ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2 ℃的环境中,
会自行毁坏
7.分析下面的能量变化示意图,确定下列选项中正确的是( )
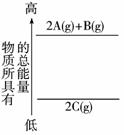
A.2A(g)+B(g)=2C(g);ΔH<0
B.2A(g)+B(g)=2C(g);ΔH>0
C.2A+B=2C;ΔH<0
D.2C(g)=2A(g)+B(g);ΔH>0
6.(2009年珠海模拟)在一定条件下发生化学反应:2SO2(g)+O2(g)=2SO23(g);ΔH=-197 kJ·mo-1L现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
2 |
1 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是( )
A.在上述条件下反应生成1 mol SO23气体放热98.5 kJ
B.上述条件下每摩尔该反应进行到底时放出的热量为197 kJ
C.Q1=2Q2=2Q3=197 kJ
D.2Q2=2Q3<Q1<197 kJ
5.(2009年四川卷)25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol
B.KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
C.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l);ΔH=-5518 kJ/mol
4.半导体工业用石英砂做原料通过三个重要反应生产单质硅

生产1.00 kg纯硅的总反应热为( )
A.-21435.71 kJ
B.-600.20 kJ
C.+21435.71 kJ
D.+1965.10 kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com