
27.(4分)在温度t℃下,某NaOH的稀溶液中c(H+)=10−a mol/L,c(OH−)=10−b mol/L,已知a+b=12,该温度下水的离子积Kw=_______;t______25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示,假设溶液混合前后的体积变化忽略不计,则c为_____________ 。
|
序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
20.00 |
0.00 |
8 |
|
② |
20.00 |
20.00 |
6 |
26.(4分)已知25℃、101kpa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
|
△H/(KJ/mol) |
-283.0 |
-285.8 |
-726.5 |
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
⑵根据盖斯定律完成下列热化学方程式 CO(g)+ 2H2(g)= CH3OH(l) △H=
25.(4分)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) 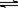 Cu2+(aq)+2OH−(aq),常温下其Ksp=c(Cu2+)
· c2(OH−)=2×10−20
Cu2+(aq)+2OH−(aq),常温下其Ksp=c(Cu2+)
· c2(OH−)=2×10−20
(1)某硫酸铜溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2 mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一可视为Cu2+沉淀较为完全),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
24.(7分) 根据下列变化关系,回答相关问题:
(1)A物质的名称____________;B溶液为______________;C试剂为________________;
(2)写出④、⑥两步反应的化学方程式
④ ____________________________________________________
⑥_____________________________________________________
23.(6分)燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取0.1 mol某气态烃A在O2中完全燃烧,生成CO2和水蒸汽,放出热量Q kJ,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2 g,碱石灰增重17.6 g。将烃A加入酸性KMnO4溶液或Br2的CCl4溶液,均能使它们褪色。
(1)写出烃A的分子式
(2)已知烃A分子结构高度对称且有两个甲基
①写出烃A使Br2的CCl4溶液褪色的化学方程式
②烃A在一定条件下可以通过加聚反应合成一种塑料,则该反应的化学方程式是
|
物质 |
加入试剂 |
操作方法 |
|
①苯(苯甲酸) |
|
|
|
②乙烷(乙烯) |
|
|
|
③肥皂(甘油) |
|
|
|
④乙醇(水) |
|
|
|
⑤乙酸乙酯(乙酸) |
|
|
22.(10分)提纯下表所列物质(括号内为少量杂质),在B中选择加入试剂,在C中选择操作的方法。填表(填入序号):
B:(1)NaCl细颗粒; (2)NaOH溶液;
(3)水; (4)CaO; (5)饱和Na2CO3;
(6)溴水; (7)KMnO4溶液。
C:(a)变性; (b)盐析; (c)蒸馏;
(d)分液; (e)结晶; (f)洗气。
21. 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积
同浓度的HCN和HClO以及同温同体积同浓度的NaCN和NaClO,下列说法正确的
是:
A 影响水的电离平衡程度:NaCN>NaClO
B 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO > HCN
C pH: HClO >HCN
D 电离程度:HCN>HClO
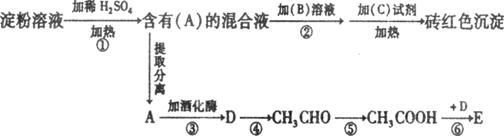
20.对于可逆反应A(g)+2B(g) 2C(g) ΔH﹥0,下列图象中正确的是
2C(g) ΔH﹥0,下列图象中正确的是
19.下列各反应的离子方程式书写正确的是
A.过氧化钠与水反应:O22−+ 2H2O = O2↑+ 4OH−
B.将氯气通入氯化亚铁溶液中:Fe2+ + Cl2 = 2Cl− + Fe3+
C.氯气与水反应:Cl2+ H2O = 2H++ Cl−+ ClO−
D.氨水中滴加盐酸:H+ + NH3·H2O = NH4+ + H2O
18.用标准浓度的盐酸滴定未知浓度的NaOH溶液,下列各操作(其他操作正确)中会造成测定结果偏低的是
A.酸式滴定管尖嘴部分有气泡,滴定后消失
B.滴定终点读数时俯视读数
C.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
D.锥形瓶水洗后未干燥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com