
20、将一定量的S和含0.7l氧气的空气(忽略2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2S2+2  2S3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2S3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)(2分)判断该反应达到平衡状态的标志是 。(填字母)
a.S2和S3浓度相等 b.S2百分含量保持不变
.容器中气体的压强不变 d. S3的生成速率与S2的消耗速率相等
S3的生成速率与S2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)(2分)欲提高S2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入2
.改变反应的催化剂 d.升高温度[:|||||]
(3)(3分)求该反应达到平衡时S3的转化率(用百分数表示)。
(4)(3分)若将平衡混合气体的5%通入过量的Bal2溶液,生成沉淀多少克?
19、(10分)废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)(2分)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
. 作为有机复合建筑材料的原料
D.直接填埋
作为有机复合建筑材料的原料
D.直接填埋
(2)(2分)用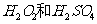 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
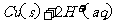 ====
====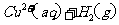
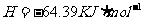
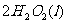 ====
====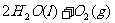
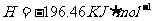
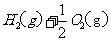 ====
==== 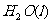
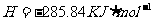
在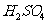 溶液中
溶液中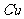 与
与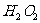 反应生成
反应生成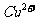 和
和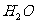 的热化方程式为 。
的热化方程式为 。
(3)(3分)控制其他条件相同,印刷电路板的金属粉末用10℅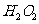 和3.0
和3.0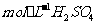 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 ( 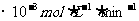 )[:.....] )[:.....] |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)(3分)在提纯后的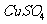 溶液中加入
溶液中加入 一定量的
一定量的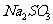 和
和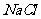 溶液,加热,生成
溶液,加热,生成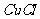 沉淀。制备
沉淀。制备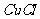 的离子方程式是
。
的离子方程式是
。
18、(每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应: 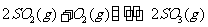
( 1)若开始时通入
1)若开始时通入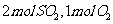 ,达平衡时生成
,达平衡时生成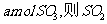 的转化率为
。
的转化率为
。
(2)若开始时通入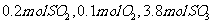 ,达平衡时S2的物质的量为 l。
,达平衡时S2的物质的量为 l。
(3)若在(2)的平衡混合物中再通入bl S3,则达到平衡时S3的体积分数是 。
17、(每空3分,共9分)在一定条件下,反应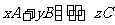 达到平衡。
达到平衡。
(1)若A、B、都是气体,在增压后平衡向逆反应方向移动,则,y,之间 的关系是
。
的关系是
。
(2)若是气体,且+y=,在增大压强时,如果平衡发生移动,则A的转化率将  (填“增大”、
(填“增大”、 “减小”或“不变”)
“减小”或“不变”)
(3)若A为固体,B、为气体,且y>,则增大压强时混和气体的平均相对分子质量将 (填“增大”“减小”或“不变”)
16、用蒸馏水逐渐稀释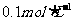 的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是(
)
的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是(
)
A.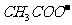 的物质的量浓度 B.
的物质的量浓度 B. 的物质的量浓度
的物质的量浓度
.H+的物质的量浓度 D.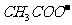 和H+的物质的量
和H+的物质的量
15、下列事实不能证明 是弱酸的是( )
是弱酸的是( )
A. 溶液能使石蕊溶液变红
溶液能使石蕊溶液变红
B.0.1
l/L的 ,H+浓度为0.01l/L
,H+浓度为0.01l/L
.等物质的量浓度的 导电能力比盐酸弱
导电能力比盐酸弱
D.0.01l/L的 溶液中有两种分子存在
溶液中有两种分子存在
14、向体积相同,pH为1的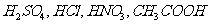 溶液中,分别加入足量的金属镁,下列说法中不正确的是(
)
溶液中,分别加入足量的金属镁,下列说法中不正确的是(
)
A. 产生的H2最多
B.HN3产生的H2最少
产生的H2最多
B.HN3产生的H2最少
.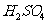 和Hl产生的H2一样多 D.
和Hl产生的H2一样多 D.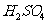 产生的H2比Hl产生的H2多
产生的H2比Hl产生的H2多
13、下列关于强、弱电解质的叙述中,正确的是( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
12、 是制备硫酸的重要反应。下列叙述正确的( )
是制备硫酸的重要反应。下列叙述正确的( )
A.催化剂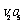 不改变该反应的逆反应速率
不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
.在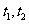 时刻,
时刻,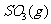 的分别是
的分别是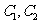 ,则时间间隔
,则时间间隔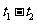 内,
内,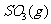 生成的平均速率为
生成的平均速率为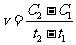
D.该反应是放热反应,降低温度将缩短反应达到平衡时间
11、已知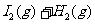

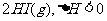 。有相同容积的定容密闭容器甲和乙,甲中加入 H2和I2各0.1l,乙中加入HI0.2l,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中的HI的平衡浓度,应采取的措施是( )
。有相同容积的定容密闭容器甲和乙,甲中加入 H2和I2各0.1l,乙中加入HI0.2l,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中的HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B.甲中加入0.1l He,乙不变
.甲降低温度,乙不变 D.甲增加0.1l H2,乙增加 0.1l I2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com