
20.(10分 每空2分)⑴60mL; ⑵1 min; ⑶D>C>B>A; ⑷随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小 ⑸此时双氧水已完全分解
19.(10分,每空2分) 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50 mL密度为 1.1 g/cm3的双氧水溶液中, 通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示。请依图回答下列问题:
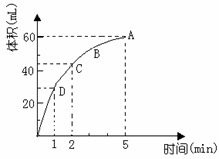 ⑴实验时放出气体的总体积为
;
⑴实验时放出气体的总体积为
;
⑵放出一半气体所需要的时间为 ;
⑶ABCD四点化学反应速率的由快到慢顺序为
⑷解释反应速率的大小变化原因_________________
________________ ;
⑸在5min后,收集到的气体体积不再增加,原因是 。
18、(10分)下表是A、B、C、D、E五种有机物的有关信息:
|
A |
 ①能使溴的四氯化碳溶液褪色; ①能使溴的四氯化碳溶液褪色;②比例模型为 ③能与水在一定条件下反应生成C2H5OH |
|
B |
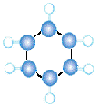 ①由C、H两种元素组成; ①由C、H两种元素组成;②球棍模型为 |
|
C |
①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
|
D |
①相对分子质量比C少2; ②能由C催化氧化得到 |
|
E |
①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A-E中,属于烃的是 (填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为
。
(3) C催化氧化生成D的化学方程式为 。
(4) 有机物B具有的性质是 (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)
E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来 比较E与碳酸酸性的强弱,则该实验的原理是
比较E与碳酸酸性的强弱,则该实验的原理是
(用化学方程式说明)。
17.(5分)(1)写出一个能证明还原性Fe比Cu强的离子方程式:
;
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液 )
;
(3)若该电池中两电极的总质量为60 g,工作一段时间后,取出两电极洗净干燥后称量,总质量为62 g,则反应过程中转移电子的数目为 。
16.(4分)某核素A ZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量 。
15.0℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
①N2O4的消耗速率与NO2的生成速率之比为1:2②NO2的生成速率与NO2消耗速率相等③烧瓶内气体的压强不再变化④烧瓶内气体的质量不再变化⑤NO2的物质的量浓度不再改变⑥烧瓶内气体的颜色不再加深⑦烧瓶内气体的平均相对分子质量不再变化⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
第Ⅱ卷(非选择题 共55分)
二 填空与简答
14.下列各组物质性质的比较正确的是
A.酸性:H3PO4>H4SiO4>H2CO3 B.熔沸点:H2O> H2Se > H2S
C.离子半径: K+ >S2->Cl- D.离子的氧化性:Na+>Mg2+>Al3+
13.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
﹢2 |
﹢3 |
﹢6、﹣2 |
﹢2 |
﹣2 |
下列叙述正确的是( )
A.离子半径大小:r(M3﹢)>r(T2﹣) B.R的氧化物对应的水化物可能具有两性
C.X单质可在氧气中燃烧生成XO3 D.L、X形成的简单离子核外电子数相等
12.X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M,X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中半径最大的元素(除稀有气体元素),下列说法正确的是( )
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.氢化物的稳定性Z >X>Y
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
11.两种气态烃的混合气体0.1mol,完全燃烧得0.15molCO2和3.6gH2O,下列对混合气体的说法正确的是
A.一定有甲烷 B.一定是甲烷和乙烯(C2H4)
C.一定有乙烷 D.一定有丙炔(C3H4)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com