
2、理解阿伏加德罗定律和以下的推论
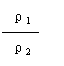 ①同T、P时,
①同T、P时,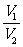 =
= 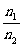 =
=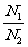 ;②同T、P时, =
;②同T、P时, =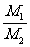 ;
;
③同T、V时,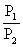 =
=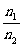 ; ④同T、P、V时,
; ④同T、P、V时, =
=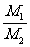 ;
;
⑤同T、P、m时,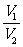 =
=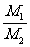 。
。
试题枚举
[例1](2004江苏)阿佛加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.标准状况下,2.24L苯中约含有3.612×1023 碳原子
B.常温常压下,氧气和臭氧的混和物16g中约含有6.02×1023 个原子
C. 25℃时,1LpH=13的氢氧化钠溶液中约含6.02×1023个氢氧根离子
D.0.5molCH4中约含有3.01×1024 个电子
解析:由于苯为液体,无法知道2.24L苯物质的量,所以A不正确。25℃时1LpH=13的氢氧化钠溶液中含氢气氧根的物质的量0.1mol即6.02×1022 即C不正确。B中16gO2与O3混和 物即含1mol氧原子。D中由于1molCH4含10mol电子,所以0.5mol中含电子数0.5×6.02×1023=3.01×1024个
答案:B、D
[例2]下列说法正确的是( )
A.1mol任何物质在标准状况下的体积都约是22.4L
B.0.5 mol氢气的体积为11.2L
C.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L
D.在20L恒容密闭容器中,充入1mol的氮气和3mol氢气,达平衡后有0.5mol的氮气反应,平衡后混合气体的体积仍为20L
解析:A.不正确,只有1mol气体在标准状况下的体积都约是22.4L,不能说任何物质。
B.不正确,因为没有指明标准状况。
C.不正确,因为三氧化硫在标准状况下不是气体。
D.正确,因为不论在任何条件下,气体都将充满整个容器。
答案:D
[例3]若以w1和w2分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A.2w1= w2 B.2 w2= w1 C.w2>2 w1 D.w1>w2>2 w1
解析:对于氨水来讲,浓度越大,密度反而越小。然后利用质量分数和物质的量浓度的转换关系,进行判断。
答案:C
[例4]假设12C相对原子质量为24,如果以0.024kg12C所含的原子数为阿伏加德罗常数,下列数值肯定不变的是
A.气体摩尔体积常数(标准状况)
B.标准状况下16g O2所占体积
C.O2的相对分子量
D.一定条件下,跟2gH2相化合的O2的物质的量
解析:以0.024kg12C所含的原子数为阿伏加德罗常数,则阿伏加德罗常数变为原来的2倍,即1mol气体的含的分子数为原来的2倍,A项变化了。B项明确了气体的温度、压强和质量,体积一定,不随原子量标准及阿伏加德罗常数的改变而改变。对于C项,由于12C相对原子质量变为原来的2倍,则任何元素的相对原子质量均变为原来的2倍,各种分子相对分子质量也将扩大为原来的2倍,即此时的O2相对分子质量变为64,对于D项,与2gH2相化合的O2的质量是不变的,因为O2的摩尔质量改变,故O2的物质的量也发生改变。
答案:B
[例5]设N表示阿伏加德罗常数,则下列说法正确的是:
A.标准状况下,以任意比例混合的甲烷和丙烷混合气体22.4L,所含的气体的分子数约为N个
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5N个
C.常温下,2.3g金属钠变成钠离子时,失去的电子数目为0.1N个
D.常温下,18g重水所含中子数为10N个
解析:A.正确,任意比例混合的甲烷和丙烷混合气体 22.4L,气体的总物质的量为1mol,因此含有N个分子。
B.不正确,因为NO和氧气一接触就会立即反应生成二氧化氮。
C.正确,2.3g钠是0.1mol钠原子,钠原子变成离子的反应为:Na-e=Na+
1、
|
n |
3、通过基本计算问题的讨论,培养学生的计算思维能力。
知识梳理
2、掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状态下)之间的相互关系。
1、掌握物质的量及其单位--摩尔、摩尔质量、气体摩尔体积的涵义。
14.

 (上海高考)某有机物A(C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂中为多。该化合物具有如下性质:
(上海高考)某有机物A(C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂中为多。该化合物具有如下性质:
(1)在25oC时,电离常数K1=3.99×10-4,K2=5.5×10-6

 (2)A+RCOOH(或ROH) 浓H2SO4/ 有香味的产物
(2)A+RCOOH(或ROH) 浓H2SO4/ 有香味的产物
(3)1molA与足量的Na→ 慢慢产生1.5mol气体
(4)A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应
试回答:(1)根据以上信息,对以上A的结构可作出的判断是 (多选扣分)
 (a)肯定有碳碳双键
(b)有两个羟基
(a)肯定有碳碳双键
(b)有两个羟基
(c)肯定有羟基 (d)有-COOR官能团
(2 )有机物A的结构简式(不含-CH3)为
(3)A在一定温度下的脱水产物和溴水反应的化学方程式

 (4)A的一个同类别的同分异构体是
(4)A的一个同类别的同分异构体是
13.(上海高考)2000年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂。苯丙醇胺(英文缩写为PPA)结构简式如下:
φ-CHOH-CHNH2-CH3
其中φ-代表苯基。苯丙醇胺是一种一取代苯,取代基是-CHOH-CHNH2-CH3。
(1)PPA的分子式是 ;
(2)PPA的取代基中有两个官能团,名称是 基和 基(写汉字)。

 (3)将-φ、-NH2、-OH在碳链上的位置作变换,可以写出多种同分异构体,其中5种的结构简式是:
(3)将-φ、-NH2、-OH在碳链上的位置作变换,可以写出多种同分异构体,其中5种的结构简式是:
φ-CHOH-CHNH2-CH3 φ-CHOH-CH2-CH2NH2
φ-CH2-CHOH-CH2NH2 φ-CHNH2-CHOH-CH3
φ-CHNH2-CH2-CH2OH
请写出另外4种同分异构体的结构简式(不要写出-OH和-NH2连在同一个碳原子上的异构体;写出多于4种的要扣分): 、
 、
、
、
、
12.今有化合物

 甲:
乙: CH3
丙: CHO
甲:
乙: CH3
丙: CHO



 -COCH3
-COOH
-CH2OH
-COCH3
-COOH
-CH2OH
 OH
OH
(1) 请写出丙中含氧官能团的名称:
(2)
 请判断上述哪些化合物互为同分异构体:
请判断上述哪些化合物互为同分异构体:
(3)
 请分别写出鉴别甲、乙、丙化合物的方法:
请分别写出鉴别甲、乙、丙化合物的方法:
 鉴别甲的方法:
鉴别甲的方法:
 鉴别乙的方法:
鉴别乙的方法:
 鉴别丙的方法:
鉴别丙的方法:
11.某芳香族化合物A的分子式为C7H6O2,溶于NaHCO3水溶液,将此溶液加热,能用石蕊试纸检验出有酸性气体产生。
(1) 写出化合物A的结构简式: ;
(2)
 依题意写出化学反应方程式:
;
依题意写出化学反应方程式:
;
(3) A有几个属于芳香族化合物的同分异构体,写出它们的结构简式。
10.速效感冒冲剂的主要成分之一为“对乙酰氨基酚”,其结构简式如下所示,有关它的叙述不正确的是 ( )
 CH3-CO-NH- -OH
CH3-CO-NH- -OH
A.能溶于热水
B.在人体内能水解
C.1mol对乙酰氨基酚与溴水反应时最多消耗Br24mol
D.与对硝基乙苯互为同系物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com