
|
|
铁 |
铜 |
|
与非金属 反应 |
2Fe+3Cl2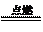 2FeCl3 2FeCl3 3Fe+2O2 3Fe+2O2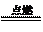 Fe3O4 Fe3O4 |
Cu+Cl2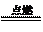 CuCl2 CuCl2Cu+O2 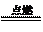 2CuO 2CuO |
|
与盐酸反应 |
Fe+2HCl====FeCl2+H2↑ |
不反应 |
|
与盐溶液 反应 |
Fe+CuSO4====CuSO4+Fe |
Cu+2AgNO3====Cu(NO3)2+2Ag |
[设问]分析铁和铜分别与盐酸、氯气等反应的实验现象和产物,你有何发现? [引导]请同学们从氧化还原反应的角度去思考:铁反应产物的化合价与什么因素有关?
[小结](ppt6)
1.Fe、Cu在一定条件下可以与某些酸、非金属单质、某些盐溶液、某些还原剂等发生反应,在反应中充当还原剂。铜在反应中一般转化为+2价的铜的化合物,铁在反应中可以转化为+2和+3价的铁离子。
[播放]古代的铁和铜制品。(ppt2、3)
[设问]古代的时候,人们已经知道利用铁和铜制作各种物品了。提起“铁”,大家对它的第一感觉是什么?
[引导]虽然铁外表看起来是黑色的,其实,纯铁是银白色的,质软的。
[展示]一块铜片、一块铁片(用砂纸打磨过)、一小瓶铁粉。
[提问]根据实物和我们生活中铁、铜的应用,归纳下铁铜的物理性质。
[讨论投影]一.单质的物理性质:(ppt4)
|
|
共同点 |
不同点 |
|
铁 |
具有金属光泽,密度较大,熔点较高,易导电、导热 |
纯净的单质铁为银白色,有良好的延展性,质地较软的固体,可被磁化 |
|
铜 |
铜具有与众不同的紫红色,质地较硬的固体 |
[提问]在前面的学习中,我们已经了解了铁、铜与其他物质发生的一些反应,请你归纳一下这些反应。
[投影](ppt5)
主要采用师生共同讨论、归纳知识与学生实验探究相结合的教学模式,通过回顾前面学习的知识来比较铜与铁性质上的异同,找出铁、铜反应后产物的不同与氧化剂强弱的规律,并通过实验探究Fe2+、Fe3+的性质以及Fe2+、Fe3+的相互转化关系,从而帮助学生构建“铁三角”关系。
教学重点:铁、铜及其化合物的性质,Fe3+与Fe2+的相互转化。
教学难点:Fe3+与Fe2+的相互转化。
(1)复习巩固已学的铁、铜的物理及化学性质;学习铁、铜的新的化学性质;学会用图示方法自主构建铁的不同价态相互转化的关系。
(2)采用实验探究的方法,掌握Fe3+、Fe2+的性质及相互转化条件,体验自主实验探究过程,培养学生分析问题和解决问题的能力。
(3)认识化学与人类生产、生活的密切关系。体会铁、铜及其化合物的使用对人类生产、生活及人类身体健康的重要作用。
2.上网查资料
①随着科技的发展,新的炼铁方法是否已应运而生?新的炼铁方法的优势何在?
②我国细菌冶金的研究和应用情况。
2.在高温下可还原氧化铁的化合物是 ( D ) A.焦炭 B.氢气 C.二氧化碳 D.一氧化碳
[结束语]通过这节课,大家都对金属铁和铜在自然界的存在方式及冶炼方法有了一个较为详尽的了解。我们知道科学技术是处在不断的发展变化之中的,新的技术、新的冶炼方法也会被逐渐地被发现。
[作业] 1.完成“练习与实践”:第4题
1.铁和铜在自然界中主要以化合物的形式存在.工业上铁的冶炼是在炼铁高炉中进行的,原料有铁矿石、焦炭、空气、石灰石等。冶炼的过程 将氧化铁还原为单质铁的方程式为:Fe2O3+3CO
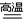
 2Fe+3CO2
。
2Fe+3CO2
。
3、生物炼铜的原理是什么?
[提问]生物炼铜有什么优点?
[巩固练习]
2. 火法炼铜:
火法炼铜:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com