
3.温室效应
(1)污染物:CO2、CH4(为CO2的20倍左右)等。
(2)危害:全球变暖使大气、海洋环流规律变化,加剧“厄而尔尼诺”现象的危害;全球变暖还使极地冰川溶化,海平面上升;引发风暴潮、盐水倒灌。
2.酸雨(pH小于5.6)
(1)污染物:氮氧化物、硫氧化物。
(2)酸雨的危害:可以侵入肺的深部组织,引起肺水肿等疾病而使人致死;引起河流、湖泊的水体酸化,严重影响水生动植物的生长;破坏土壤、植被、森林;腐蚀金属、油漆、皮革、纺织品及建筑材料;渗入地下,使水中铝、铜、锌、镉的含量比中性地下水中高很多倍。
(3)酸雨的治理
① 钙基固硫:S+O2 SO2、SO2+CaO
SO2、SO2+CaO CaSO3、2CaSO3+O2
CaSO3、2CaSO3+O2 2CaSO4(变废为宝)。
2CaSO4(变废为宝)。
② 尾气处理
a.氨水吸收法:2NH3+SO2+H2O (NH4)2SO3
(NH4)2SO3
(NH4)2SO3+H2SO4 SO2↑+H2O+(NH4)2SO4(作化肥)
SO2↑+H2O+(NH4)2SO4(作化肥)
b.石灰乳吸收法:SO2+Ca(OH)2 CaSO3+H2O
CaSO3+H2O
2CaSO3+O2+4H2O 2CaSO4·2H2O(石膏,变废为宝)
2CaSO4·2H2O(石膏,变废为宝)
c.饱和Na2SO3溶液吸收法:Na2SO3+SO2+H2O 2NaHSO3
2NaHSO3
2NaHSO3 Na2SO3+SO2↑+H2O(Na2SO3可循环使用)
Na2SO3+SO2↑+H2O(Na2SO3可循环使用)
1.臭氧空洞
(1)污染物:CF2Cl2、NOx等
(2)机理:CF2Cl2在高空紫外线作用下产生氯原子,作O3分解的催化剂。NOx直接作O3分解的催化剂。
(3)危害:紫外辐射增强使患呼吸系统传染病的人增加;受到过多的紫外线照射还会增加皮肤癌和白内障的发病率;强烈的紫外辐射促使皮肤老化;使城市内的烟雾加剧,使橡胶、塑料等有机材料加速老化,使油漆褪色等。
3.晶体结构与性质--物理性质
(1)晶体类型及其性质
|
|
离子晶体 |
分子晶体 |
原子晶体 |
金属晶体 |
|
组成微粒 |
阴、阳离子 |
分子 |
原子 |
金属离子和自由电子 |
|
微粒间的相互作用 |
离子键 |
分子间作用力 |
共价键 |
金属键 |
|
是否存在单个分子 |
不存在 |
存在 |
不存在 |
不存在 |
|
熔、沸点 |
较高 |
低 |
很高 |
高低悬殊 |
|
硬度 |
较大 |
小 |
很大 |
大小悬殊 |
|
导电情况 |
晶体不导电, 溶于水或熔融状态下导电 |
晶体或熔融状态下不导电, 溶于水时部分晶体能导电 |
晶体为半导体或绝缘体 |
晶体导电 |
 (2)晶体熔、沸点高低的比较
(2)晶体熔、沸点高低的比较
一般规律:原子晶体>离子晶体>分子晶体。
② 分子晶体:组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,晶体的熔、沸点越高。
例如:F2<Cl2<Br2<I2。
此外,当分子形成分子间氢键时,分子晶体的熔、沸点升高。
例如:NH3、H2O、HF的熔、沸点均比同主族下一周期的氢化物来的高。
③ 原子晶体:原子半径越小,键长越短,键能越大,键越牢固,晶体的熔、沸点越高。
例如:金刚石>二氧化硅>金刚砂>晶体硅。
2.分子结构与性质
(1)化学键--化学性质(决定分子的稳定性)
|
|
离子键 |
共价键 |
金属键 |
|
成键微粒 |
阴、阳离子 |
原子 |
金属离子和自由电子 |
|
微粒间相互作用 |
静电作用 |
共用电子对 |
静电作用 |
|
成键原因 |
活泼金属(如ⅠA、ⅡA)和活泼非金属(如ⅥA、ⅦA) |
成键原子具有未成对电子 |
金属 |
④ 等电子原理
b.常见等电子体:N2、CO、(电子总数为14e–,存在叁键);
CO2、CS2、(价电子数为16e–,均为直线型);
① 与键的极性有关;② 与分子的空间构型有关。
|
类型 |
实例 |
键角 |
键的极性 |
空间构型 |
分子的极性 |
|
A2 |
H2、N2、Cl2等 |
― |
非极性键 |
直线形 |
非极性分子 |
|
AB |
HCl、NO、CO等 |
― |
极性键 |
直线形 |
极性分子 |
|
AB2 |
CO2、CS2等 |
180° |
极性键 |
直线形 |
非极性分子 |
|
H2O、H2S等 |
<180° |
极性键 |
“V”形 |
极性分子 |
|
|
SO2分子 |
120° |
极性键 |
三角形 |
极性分子 |
|
|
AB3 |
|
|
|
|
|
|
AB4 |
NH3、PCl3等分子 |
<109.5° |
极性键 |
三角锥形 |
极性分子 |
|
CH4、CCl4等分子 |
109.5° |
极性键 |
正四面体形 |
非极性分子 |
|
|
|
|
|
|
|
|
(4)相似相溶原理:极性相似,相互溶解,极性相差越大,则溶解度越小。
如:水为强极性分子,强极性的HX、NH3等易溶于水;
有机物均为弱极性或非极性分子,有机物间可相互溶解。
(5)共价键的类型
① 电子对是否偏移:极性键和非极性键。
(6)分子间作用力及氢键--物理性质
① 分子间作用力--范德华力
对于分子组成和结构相似的物质,其相对分子质量越大,范德华力越大,熔、沸点越高。
例如:沸点 F2<Cl2<Br2<I2。
② 氢键
a.形成氢键的因素:含N、O、F,且含有与N、O、F直接相连的H。
b.氢键对物质性质的影响:分子间氢键的形成,使物质在熔化或汽化的过程中,还需克服分子间的氢键,使物质的熔、沸点升高;分子间氢键的形成,可促进能形成氢键的物质之间的相互溶解。
1.原子结构与性质
 原子核:同位素、原子量--物理性质
原子核:同位素、原子量--物理性质
(1)原子(AZX)
核外电子--化学性质
(2)元素的化学性质主要由原子最外层电子数和原子半径决定。
例如:最外层电子数相等,半径不等(同主族元素),性质出现递变性;
Li和Mg、Be和Al的最外层电子数不等,半径相近,性质相似。
5.常见离子的检验方法
|
离子 |
检验方法 |
主要现象 |
|||
|
H+ |
酸碱指示剂;活泼金属Zn;碳酸盐等 |
变色,产生氢气,产生CO2气体 |
|||
|
Na+、K+ |
焰色反应 |
钠“黄”钾“紫” |
|||
|
Al3+ |
OH– |
先生成白色沉淀,后白色沉淀溶解形成无色溶液 |
|||
|
Fe3+ |
KSCN溶液,NaOH溶液 |
溶液变红色,生成红褐色沉淀 |
|||
|
NH4+ |
NaOH溶液、加热 |
生成能使湿润的红色石蕊试纸变蓝的气体 |
|||
|
OH– |
酚酞溶液 |
溶液变红色 |
|
|||
|
Cl– |
AgNO3、稀硝酸 |
生成不溶于稀硝酸的白色沉淀 |
|
|||
|
SO42– |
稀HCl、BaCl2溶液 |
生成不溶于HCl的白色沉淀 |
|
|||
|
CO32– |
盐酸、澄清石灰水 |
生成使澄清石灰水变浑浊的无色无味气体 |
|
|||
4.物质的分离和提纯
(1)物质分离提纯的常用方法
|
方法 |
适用范围 |
举例 |
|
过滤 |
分离不溶性固体和液体混合物 |
粗盐提纯时,将粗盐溶于水,过滤除去不溶性杂质 |
|
结晶 |
分离溶解度随温度变化差别大的固体混合物 |
分离KNO3和NaCl的混合物 |
|
蒸发 |
除去溶液中的挥发性溶剂 |
从食盐水中提取食盐 |
|
蒸馏 |
分离沸点差别大的液体混合物 |
由普通酒精制取无水酒精 |
|
萃取 |
提取易溶于某种溶剂的物质 |
用CCl4提取I2水中的I2 |
|
分液 |
分离互不相溶的液体混合物 |
分离水和苯的混合物 |
(2)物质分离提纯的常用化学方法
①溶解法:利用特殊的溶剂(或试剂)把杂质溶解而除去,或提取出被提纯物质的一种方法。
②沉淀法:利用沉淀反应将杂质转化为沉淀而除去,或将被提纯物质转化为沉淀而分离出来。
③转化法:将杂质转化为被提纯物质而除去的一种方法。
④加热分解法:通过加热将杂质转化成气体而除去的一种方法。
⑤酸碱法:通过加酸、碱调节溶液的pH,从而使杂质转化为沉淀而除去。
⑥氧化还原法:通过加氧化剂或还原剂,将杂质转化为气体、沉淀或其它物质而除去。
⑦离子交换法:通过离子交换树脂除去溶液中的特定离子。
3.常见实验装置
(1)气体发生装置:固、固加热型;固、液不加热型;固(液)、液加热型。




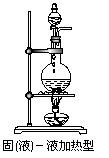

(2)各种防倒吸装置--用于防止液体的倒吸。

(3)常见的净化装置和尾气吸收装置
① 常见的净化装置--用于除去气体中的杂质气体。

② 常见的尾气吸收装置--用于吸收尾气。

(4)常见的量气装置--通过排液法测量气体的体积。

(5)过滤、蒸馏、分液装置



2.中学化学实验中的温度计
(1)测液体的温度:如测物质溶解度;实验室制乙烯等。
(2)测蒸气的温度:如实验室蒸馏石油;测定乙醇的沸点等。
(3)测水浴温度:如温度对反应速率影响的反应;苯的硝化反应;苯的磺化反应;制酚醛树脂;银镜反应;酯的水解等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com