
9、(2005年上海)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
8.(16分)(2004全国) O
‖
抗击“非典”期间,过氧乙酸(CH3C-O-OH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
 ① □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
① □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
 ② H2O2+2
② H2O2+2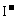 +2H+
I2+2H2O
+2H+
I2+2H2O
O
‖
 ③ CH3C-O-OH+2
③ CH3C-O-OH+2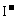 +2H+
CH3COOH+I2+H2O
+2H+
CH3COOH+I2+H2O
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
 □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
□MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·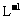 的KmnO4标准溶液
的KmnO4标准溶液
滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不
与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·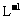 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是
否影响测定结果 _______________(填是或否)
7.(08广东卷)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
6.(2006年江苏)配制100 mL 1.0 mol/LNa2C03溶液,下列操作正确的是 ( )
A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒人容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
5.(2005年广东)将钠、镁、铝各0.3mol 分别放入100mL 1 mol/L 的盐酸中,同温同压下产生的气体体积比是
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
4、(2005年全国)已知Q与R的摩尔质量之比为9:22,在反应X + 2Y = 2Q + R 中,当1.6 g X 与Y完全反应后,生成4.4 g R,则参与反应的Y和生成Q的质量之比为
A、46:9 B、32:9 C、23:9 D、16:9
3、(2005年广东)下列于化学有关的叙述正确的是
A.铜锌原电池中,铜为负极
B.0.1molN2与0.3molH2在一定条件下反应达到平衡时,生成0.2molNH3。
C. 1mol/LAlCl3溶液中,铝离子物质的量浓度为1mol/L。
D.18gH2O中含1mol氧原子
2.下列叙述正确的是
A 直径介于1nm-100nm之间的微粒称为胶体
B 电泳现象可证明胶体属电解质溶液
C 利用丁达尔效应可以区别溶液与胶体
D 胶体粒子很小,可以透过半透膜
1.(2004上海卷)氢氧化铁胶体稳定存在的主要原因是
A.胶粒直径小于1nm B.胶粒作布郎运动
C.胶粒带正电荷 D.胶粒不能通过半透膜
(五)完成练习:《第二课堂》部分习题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com