
5.小结(引导学生总结学习本文的收获,4分钟)
① 认识了一个畸形时代,人性被扭曲、精神受伤害的情况。② 明白了作者呼唤人性、讴歌人性的时代意义。
3.小组合作探究(10分钟)
同学们,刚才你们都读了巴金反映文革动乱时人们心态的《小狗包弟》,大家的感受和发现肯定是各不相同的,各有认识深刻的地方和发现的问题。现在进行小组合作探究,首先探究你们自己发现的问题,然后探究老师提供的问题。
①你对特定环境里的“狗性”和人性是怎样认识的?(主要结合第一段讨论)②从包弟的讨人喜爱到它被送上解剖桌,你是怎样认识的?(要做客观的、全面的、设身处地的分析)③巴金送走包弟先感到“轻松”,随后又感到“沉重”,这个心理变化说明了什么?④你对巴金所受的“熬煎”是怎样的认识的?
思考领悟:本文写作的基调是什么?为什么作者如此确定?
品味鉴赏:本文的思想价值和艺术特色。
1.小组快速检查交流访问和积累的情况。(3分钟)
①文革动乱时人们的心态及人际关系;②巴金及其作品的有关知识材料。
2、 通过网络等手段查阅整理并积累关于巴金及其作品的有关知识材料。
1.访问身边2-3名70岁左右的文革中的“走资派”,了解文革动乱中的人际关系情况,并做好访谈录。
12.(2007年江苏(8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺 一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器 中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内
溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1
(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
11.(2007年江苏(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],
然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置
5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数
(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
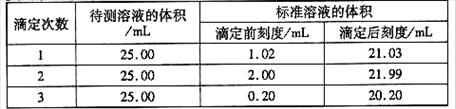
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
10、(2007年天津)取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O == SO42- + 2Fe2+ + 4H+
Cr2O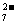 + 6 Fe2+ + 14 H+ == 2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ == 2 Cr3+ + 6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com