
27.(9分)A是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平,
D是一种酸性物质,E是具有果香气味的烃的衍生物。A、B、C、D在一定条件下存在如下转化关系(石蜡油含17个碳原子以上的液态烷烃,部分反应条件、产物被省略)。
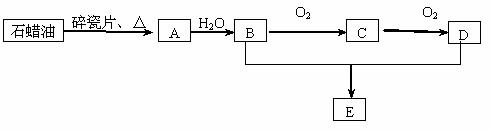
⑴工业上,由石油获得汽油、煤油、石蜡油等成份的方法是 ,
(2)写出A、B的结构简式 ;
(3) A→B的反应类型是 ;
B+D→E的反应类型是 反应方程式为:
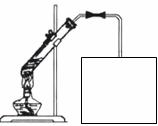
(4)实验室常用如图所示装置制取D,请在下图所示方框中补充画出有关仪器,并标明所盛药品的名称。
26.(8分)某有机物的结构简式为HO-CH2-CH=CH-CH=CH-CHO。
(1)、请你写出下列官能团
“ 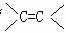 ”、“HO-”、“-CHO”的名称: 、 、 。
”、“HO-”、“-CHO”的名称: 、 、 。
(2)、验证该有机物中含有“-CHO”,常采用的试剂是 ,产生的现象为 。
(3)、该有机物的性质描述正确的有
A、与金属Na反应放出O2 B、能与新制Cu(OH)2反应,产生红色沉淀
C、不能发生银镜反应 D、一定条件下能与H2发生加成反应
(4)1mol该有机物完全与溴水发生加成反应时,需要Br2 mol
25.(9分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
能形成双原子分子,原子间存在3对共用电子对 |
|
X |
M层有3个电子 |
|
Y |
最外层电子数是最内层电子数2倍,其最高价氧化物是一种固体,用于生产光导纤维 |
|
Z |
最低负价为-2价,且无最高正价 |
用化学符号回答以下问题:
(1) 比较:氢化物的稳定性:T Z,最高价氧化物对应水化物的酸性:T Y。(填“>”、“<”或“=”)
(2)Y元素位于元素周期表中第 周期,第 族。
请你设计一实验方案,证明X的氯化物是离子化合物还是共价化合物。简要写出实验内容、现象和结论。 。
(3) X的最高价氧化物对应水化物与烧碱反应的离子方程式为: 。
(4) T、X、Y、Z四种原子的半径由大到小的顺序为: 。
24.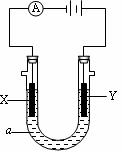 (7分) 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
(7分) 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
(1)电解过程中反应的总化学方程式为 ;
X极附近观察到的现象是 _。
(2)Y电极上的电极反应式为 _______;
检验该电极反应产物的方法是 _________。
23.(6分)按要求填空:
(1) 与Ne原子电子层结构相同的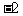 价阴离子,填写微粒的结构示意图: _____;
价阴离子,填写微粒的结构示意图: _____;
(2)用电子式表示两核10电子的共价化合物形成过程: ;
(3)在1-18号元素中,气态氢化物的水溶液呈碱性的化合物的结构式:__________ 。
(4)相对分子质量为58的烷烃的分子式是_______________,
它可能的结构简式是 ___________________________________________________
22. 化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是
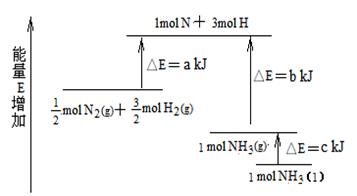
A.N2(g)+3H2(g) = 2NH3 (l);⊿H = 2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b-a)kJ·mol-1
C.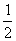 N2(g)+
N2(g)+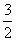 H2(g)
= NH3(l) ;⊿H = (b+c-a)kJ·mol-1:
H2(g)
= NH3(l) ;⊿H = (b+c-a)kJ·mol-1:
D.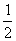 N2(g)+
N2(g)+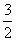 H2(g)
=NH3(g) ;⊿H = (a+b)kJ·mol-1
H2(g)
=NH3(g) ;⊿H = (a+b)kJ·mol-1
21.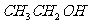 和
和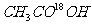 在一定条件下充分反应后,得到的产物为( )
在一定条件下充分反应后,得到的产物为( )
A. 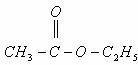 和
和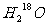 B.
B. 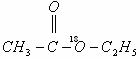 和
和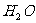
C. 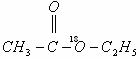 和
和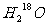 D.
D. 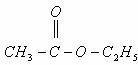 和
和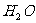
20.下列说法中,正确的是( )
A. 在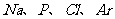 四种元素中,最高正化合价数值最大的是P
四种元素中,最高正化合价数值最大的是P
B. 在N、F、Mg、Cl四种元素中,原子半径最小的是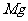
C. 原子序数从3-10的元素,随着核电荷数的递增,原子的最外层电子数递增
D. 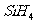 (硅烷)比
(硅烷)比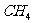 稳定
稳定
19.下列说法中不正确的是
A.水被通电分解时,水分子内的化学键被破坏
B.一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3
C.铁质器件附有铜质配件,在接触处易生铁锈
D.干冰气化时,没有破坏二氧化碳分子内的化学键
18.苯的结构简式可用 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )
A.苯主要是以石油为原料而获得的一种重要化工原料
B.苯中含有碳碳双键,所以苯属于烯烃
C.苯分子中6个碳碳化学键完全相同
D.苯可以与溴水、高锰酸钾溶液反应而使它们褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com