
2、 掌握离子检验的一般程序和基本操作,初步掌握有机物官能团检验的一般思路和程序
1、 掌握常见离子和官能团的检验方法
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
3.同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是 ( )
A. 它是一种共价化合物 B. 在加热时此化合物可以分解
C. 这种化合物不能跟碱发生反应 D. 该化合物可以由PH3跟HI化合而成
4在两种短周期元素组成的化合物中,它们的原子个数比为1:2,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是 ( )
①a+b=15 ②a=b+15 ③a=b-5 ④a+b=22
A. ①④ B. ①③④ C. ①②③④ D. ①②④
5根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
6重水A与普通水B分别跟足量的金属钠反应,下列叙述正确的是 ( )
A. A、B的质量相等时,产生气体的体积在同温、同压下相等
B. A、B的质量相等时,产生气体的质量相等
C. A、B的物质的量相等时,产生气体的体积在同温、同压下相等
D. A、B的物质的量相等时,产生气体的质量相等
7短周期元素X、Y,X的原子序数小于Y的原子序数,二者可以形成两种气态化合物A和B。已知在相同条件下,A、B的密度之比为15:22,且当A、B以体积比1:3混合后,对H2的相对密度为20.25。试写出X、Y的元素符号及A、B的化学式。
8 A、B、C、D、E五种元素,它们的核电荷数按C、A、B、D、E顺序增大,C、D都能分别与A按原子个数比为1:1或1:2形成化合物,CB可与EA2反应生成C2A与气体物质EB4,E的M层电子数是K层电子数的2倍。请回答:
⑴写出这五种元素的名称:A________,B_________,C________,D________,E_______;
⑵画出E原子结构示意图:_________________________;
⑶写出D2A2和EB4的电子式:_____________,_____________;
⑷写出D单质与铜盐溶液反应的离子方程式:____________________________________。
9设想你去某外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到下列结果:
|
单质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
熔点(℃) |
-150 |
550 |
160 |
210 |
-50 |
370 |
450 |
300 |
260 |
250 |
|
与水反应 |
|
√ |
|
|
|
√ |
√ |
√ |
|
|
|
与酸反应 |
|
√ |
|
√ |
|
√ |
√ |
√ |
|
√ |
|
与氧气反应 |
|
√ |
√ |
√ |
|
√ |
√ |
√ |
√ |
√ |
|
不发生化学反应 |
√ |
|
|
|
√ |
|
|
|
|
|
|
相对于A元素的 原子质量 |
1.0 |
8.0 |
15.6 |
17.1 |
23.8 |
31.8 |
20.0 |
29.6 |
3.9 |
18.0 |
按照元素性质的周期递变规律,试确定以上十种元素的相对位置,并填入下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 已知1个N2O3分子的质量为akg,1个N2O5分子的质量为bkg,若以1个氧原子(16O)质量的1/16作为相对原子质量的标准,则NO2的式量为_______________。
11下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
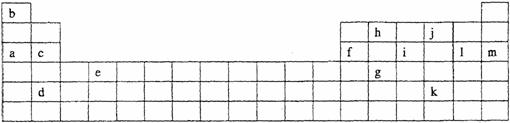
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
3.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
[经典题型]
题型一:几个量的关系(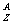 X)
X)
例1 已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含质子的物质的量是 ( A )
A. 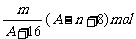 B.
B.
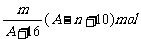
C. (A-n+2)mol
D. 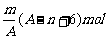
点拨: 由A→M→n→N
规律总结:
质量数(A)=质子数(Z)+中子数(N)
质子数=核电荷数=原子序数=原子的核外电子数
离子电荷数=质子数-核外电子数
巩固:1 以NA表示阿佛加德罗常数,下列说法中正确的是 ( B )
A 53g碳酸钠中含NA个CO32- B 0.1molOH-含NA个电子
C 1.8g重水(D2O)中含NA个中子
D 标准状况下11.2L臭氧中含NA个氧原子
题型二:0族元素的原子序数和电子排布及电子排布的规律运用
例2 写出10电子的微粒的化学式
指出53号元素在周期表中的位置
点拨:10电子的稳定结构→Ne→以Ne为中心→左右移动
54号元素是第5号0族元素→回答的是53号→前推一位
规律总结:
0族元素的原子序数和电子排布的规律很强:2、10、18、36、54、86、118相隔二个8、二个18、二个32;8、18、32就是该周期容纳的元素种类。阴、阳离子的稳定结构就是向最近的0族靠。
例3 R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2。它可能形成的含氧酸根离子有①R2O42-、②RO4-、③R2O32-、④RO3-。下列判断正确的是 ( BC )
A. 当它形成①时,不可能形成④ B. 当它形成②时,不可能形成③、④
C. 当它形成①时,不可能形成②、③ D. 当它形成②时,可以形成①
点拨:易漏解应全面思考
规律总结:
⑴核外电子是由里向外,分层排布的。
⑵各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。
⑶以上几点互相联系。
核外电子排布规律是书写结构示意图的主要依据。
巩固:2 具有下列结构的原子一定属于碱金属的是 ( CD )
A. 最外层只有1个电子 B. 最外层电子数为次外层电子数的一半
C. M层电子数为K层电子数的一半 D. K、L层电子数之和比M、N层电子数之和大1
3 分别处于第二、三周期的主族元素A和B,它们的离子的电子层相差2层。已知A处于第m族;B处于第n族;A只有正化合价。则A、B原子核外电子总数分别为 ( D )
A. m、n B. 3、7 C. m-2、10n D. m+2、n+10
题型三:推断元素原子序数差
例4 若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是 (D)
A. 1 B. 2 C. 5 D. 6
点拨:设两种元素的符号分别为X和Y,则化合物的化学式为X2Y3,即X为+3价,Y为-2价,在短周期元素中满足此要求的X元素有5B、7N、13Al,Y元素有8O和16S。
规律总结:
从化合价入手或从直觉----代表物入手都可以。
巩固:4 周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子个数之比为1︰2。写出这些化合物的化学式 。
题型四:位、构、性三者关系
例5 下表是X、Y、Z三种元素的氢化物的某些性质: ( B )
|
元素 |
熔点/℃ |
沸点/℃ |
与水的反应 |
导电性(纯液体) |
|
X |
-283 |
-162 |
不反应 |
不导电 |
|
Y |
-102 |
19 |
放热反应,形成酸性溶液 |
不导电 |
|
Z |
680 |
/ |
剧烈反应,生成H2,并形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
A. X、Y、Z B. Z、X、Y C. Y、X、Z D. Z、Y、X
点拨:导电性→化合物类型;与水反应→氢化物的稳定性
例6 砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物不可能具有的性质是(A)
A. HAt很稳定 B. 易溶于某些有机溶剂
C. AgAt不溶于水 D. 是有色固体
点拨:位近性近
例7 在一定条件下,RO3n-中和氟气可发生如下反应:
RO3n- + F2 +2OH-=RO4- +2F-- +H2O 已知R为短周期元素,则可知在RO3n--中,元素R的化合价是 ;元素R在周期表中的位置是 。
点拨:离子方程式的电荷守恒和氟无正价
规律总结:结构决定位置,结构决定性质,位置体现性质。
周期数=电子层数
主族数=最外层电子数=最高正价数
|最高正价|+|负价|=8
巩固:5 X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是 。
6 同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是 ( )
A. 含氧酸的酸性:H3ZO4>H2YO4>H3XO4 B. 非金属性:X>Y>Z
C. 气态氢化物的稳定性按X、Y、Z顺序由弱到强
D. 元素的负化合价的绝对值按X、Y、Z顺序由小到大
7 周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。已知三种元素的原子最外层电子数之和为19,三种元素的原子核中质子数之和为41。则这三种元素是A___S__、B__Cl___、C___O___(填元素符号)。
随堂作业:
1 设某元素某原子核内的质子数为m,中子数为n,则下述论断中正确的是
A. 不能由此确定该元素的相对原子质量
B. 这种原子的相对原子质量为m+n
C. 若碳原子质量为wg,此原子的质量为(m+n)wg
D. 核内中子的总质量小于质子的质量
2 X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是 (D)
A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Z>Y>X
2.掌握元素周期表(长式)中0族元素的原子序数和电子排布。
1.掌握原子序数、核电荷数、质子数、中子数、核外电子数、质量数之间的相互关系。
4、正确区分脱氨基作用和氨基转换作用
脱氨基作用是将氨基酸的氨基脱去形成含氮和不含氮两部分,它是破坏氨基酸的过程,因此使得氨基酸的数目减少了。氨基转换作用是指将一种氨基酸转变成另外一种氨基酸,因此氨基酸的数目并没有减少。但是在生物体内并不是所有的氨基酸都能通过氨基转换作用生成,例如人体就有8种氨基酸在体内不能形成,称之为必需氨基酸。
3、三大营养物质代谢的关系
(1)糖类代谢和蛋白质代谢的关系
糖类和蛋白质在体内是可以相互转化的。几乎所有组成蛋白质的天然氨基酸都可以通过脱氨基作用,形成的不含氮部分进而转变成糖类;糖类代谢的中间产物可以通过氨基酸转换作用形成非必需氨基酸。注意:必需氨基酸在体内不能通过氨基转换作用形成。
(2)糖类代谢与脂质代谢的关系
糖类代谢的中间产物可以转化成脂肪,脂肪分解产生的甘油、脂肪酸也可以转化成糖类。糖类可以大量转化成脂肪,而脂肪却不能大量转化成糖类。
(3)蛋白质代谢和脂质代谢的关系
一般情况下,动物体内的脂肪不能转化为氨基酸,但在一些植物和微生物体内可以转化;一些氨基酸可以通过不同的途径转变成甘油和脂肪酸进而合成脂肪。
(4)糖类、蛋白质和脂质的代谢之间相互制约
糖类可以大量转化成脂肪,而脂肪却不可以大量转化成糖类。只有当糖类代谢发生障碍时才由脂肪和蛋白质来供能,当糖类和脂肪摄入量都不足时,蛋白质的分解才会增加。例如糖尿病患者糖代谢发生障碍时,就由脂肪和蛋白质来分解供能,因此患者表现出消瘦。
2、三大营养物质代谢的不同点
(1)能否在体内储存
糖类和脂肪都可以在体内储存,但蛋白质不能在体内储存。
(2)代谢终产物不完全相同
糖类和脂肪的代谢终产物都是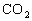 和
和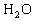 ,但是蛋白质的代谢终产物除了它们外还有尿素。
,但是蛋白质的代谢终产物除了它们外还有尿素。
(3)在体内的主要用途不同
糖类主要是氧化分解提供生命活动所需的能量,脂肪主要是在体内再次合成为脂肪储存起来,蛋白质被消化分解成氨基酸之后,主要用来合成生物体内各种组织蛋白以及酶和某些激素等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com