
10.函数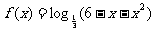 的单调递增区间是
的单调递增区间是
A.[-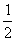 ,+∞) B.[-
,+∞) B.[-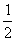 ,2) C.(-∞,-
,2) C.(-∞,-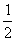 ) D.(-3,-
) D.(-3,-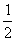 )
)


9. 定义在R上的偶函数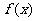 满足
满足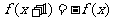 ,且在[-1,0]上单调递增,设
,且在[-1,0]上单调递增,设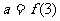 ,
,
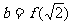 ,
,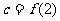 ,则
,则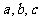 大小关系是
大小关系是
A. B.
B.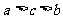 C.
C.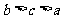
 D.
D.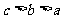

7. 已知函数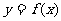 的图象在点(1,f(1))处的切线方程是
的图象在点(1,f(1))处的切线方程是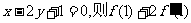 的值是
的值是 
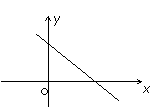 A.
A.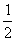 B.1
C.
B.1
C.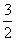 D.2
D.2
|
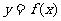 的图象经过原点,且它的导函数
的图象经过原点,且它的导函数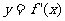 的图象是如图所示的一条直线,则
的图象是如图所示的一条直线,则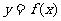 的图象不经过
的图象不经过 
A.第一象限
B.第二象限
C.第三象限
D.第四象限

6.函数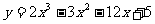 在[0,3]上最大,最小值分别为
在[0,3]上最大,最小值分别为 
A. 5,-15 B. 5,4 C. -4,-15 D. 5,-16
5.已知函数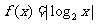 ,则下列不等式成立的是
,则下列不等式成立的是
A.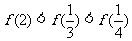 B.
B.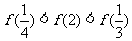

C. 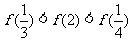 D.
D.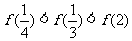

4.函数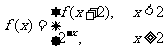 ,则
,则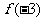 的值为
的值为
A.2 B.8 C.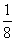 D.
D.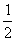

3.下列函数中,在其定义域内既是奇函数又是减函数的是
A. 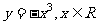 B.
B. 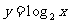

C.  D.
D. 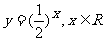

2.使不等式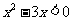 成立的必要不充分条件是
成立的必要不充分条件是
A.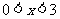 B.
B.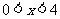 C.
C. D.
D.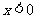 ,或
,或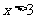

1.已知集合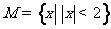 ,
, ,则集合
,则集合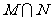 等于
等于
A.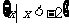 B.
B.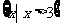

C.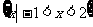 D.
D.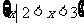

3、 能够设计离子检验和官能团检验的实验方案并能对实验过程进行评价。
知识梳理
知识点1 常见阳离子的检验方法
|
离子 |
检验试剂 |
实验现象 |
离子方程式 |
|
H+ |
|
|
|
|
Na+ |
|
|
|
|
Ba2+ |
|
|
|
|
Mg2+ |
|
|
|
|
Al3+ |
|
|
|
|
Fe2+ |
|
|
|
|
Fe3+ |
|
|
|
|
Cu2+ |
|
|
|
|
Ag+ |
|
|
|
|
NH4+ |
|
|
|
知识点2 常见阴离子的检验方法:
|
离子 |
检验试剂 |
实验现象 |
|
 |
|
|
|
 |
|
|
|
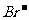 |
|
|
|
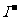 |
|
|
|
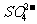 |
|
|
|
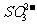 |
|
|
|
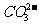 |
|
|
|
知识点3 常见气体的检验:
⑴H2,无色、无味有还原性。可点燃。火焰呈浅蓝色。(不纯氢气点燃有爆鸣声)
⑵O2,无色、无味,用带火星的木条检验,使木条复燃。
⑶CO, 无色、无味有还原性。可点燃,火焰呈浅蓝色,产物可使石灰水变浑浊。
⑷CO2,无色,①燃着的木条放入集气瓶,木条熄灭。②气体通入石灰水,石灰水变浑浊。
⑸Cl2,黄绿色、有刺激性气味,溶于水,有漂白性、氧化性,可使湿润的淀粉KI试纸变蓝。
⑹HCl,无色、有刺激性气味的气体。①可使沾有浓氨水的玻璃棒产生白烟。②可使湿润的蓝色石蕊试纸变红。③将少量硝酸银和稀硝酸加入集气瓶,产生白色沉淀。
⑺SO2,无色有刺激性气味,通入品红溶液红色退去,再加热。又出现红色。
⑻NH3,无色有刺激性气味,①可使沾有浓盐酸的玻璃棒产生白烟。②可使湿润的红色石蕊试纸变蓝。
⑼ NO,无色气体,打开瓶口与空气接触,立即变为红棕色气体。
⑽ NO2,红棕色、刺激性气味,易溶于水并反应。①溶于水,溶液无色但能使紫色石蕊试液变红。②可使湿润的淀粉KI试纸变蓝。
⑾CH4,无色无味,①点燃,为淡蓝色的火焰,产物为H2O和CO2.
⑿C2H4, 无色,①点燃,火焰明亮,略有黑烟。②可使溴水或酸性KMnO4溶液退色。
⒀C2H2,无色无味,①点燃,火焰明亮,有大量黑烟。②可使溴水或酸性KMnO4溶液退色。
知识点4 重要有机物的检验
|
物质 |
使用的试剂 |
操作方法和现象 |
化学反应方程式 |
|
甲苯 |
|
|
|
|
卤代烃R-X |
|
|
|
|
乙醇C2H5OH |
|
|
|
|
苯酚 |
|
|
|
|
蛋白质 |
|
|
|
|
淀粉 |
|
|
|
|
葡萄糖(醛) |
|
|
|
知识点5 物质检验的一般程序及答题要领
⑴实验操作:
通常分两步进行,第一部取少量试样(如试样是固体的要先配制成溶液)放入容器(通常用试管)。第二步各取少许溶液,根据要求在试样中加入已知成分和性质的试剂,并根据所发生的现象,进行分析、判断,作出结论。
⑵答题要领:
①不许用原瓶操作:鉴别的目的是为了以后的使用,若用原瓶操作,污染了原瓶中的试剂。要有“各取少许”字样。
②不许“指名道姓”:结论的得出,来自实验现象,在加入试剂之前,该物质是未知的,应该叙述为“若……(现象),则证明有……”,叙述时不可出现“取某某物质加入某某试剂……”的字样,一般间答顺序为:各取少许→溶解→加入试剂→描述现象→得出结论。
知识点6 气体检验方法和思路:
⑴检验气体的思路一般从以下几个方面考虑:①气体的颜色和气味;②水溶液的酸碱性;③助燃、可燃及燃烧现象和产物;④遇空气的变化;⑤其它特性。
⑵方法:
①观察法:对于有特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、I2蒸汽(紫色)科举颜色辨别。
②溶解法:根据溶于水现象不同区分。如NO2和Br2蒸汽均为红棕色,但溶于水后NO2形成无色溶液,Br2形成橙色溶液。
③退色法:如SO2和CO2克用品红溶液区分。
④氧化法:被空气氧化看变化,如NO的检验。
⑤试纸法:利用各种试纸来检验。
⑥星火法:适用于由助燃性或可燃性的气体的检验。如O2使带火星的木条复燃;
知识点7 有机物官能团的检验
结构决定性质,官能团体现结构,选取典型试剂检验对应的官能团是有机物检验的关键,常用试剂如下:
①KMnO4酸性溶液:烯烃、炔烃、苯的同系物、醇、酚、醛、甲酸、等均可使酸性高锰酸钾溶液退色。
②溴水:烯烃、炔烃等一切不饱和有机物、酚、醛、甲酸、等均可使溴水退色(加成或氧化反应)。
③银氨溶液:凡含有-CHO的有机物如醛、甲酸、甲酸盐、甲酸酯、葡萄糖均可发生银镜反应。
④新制的Cu(OH)2碱性悬浊液:含 -CHO的物质与新制的Cu(OH)2碱性悬浊液加热煮沸有砖红色的Cu2O沉淀生成。
⑤FeCl3溶液:与苯酚反应生成紫色溶液。
试题枚举
[例1]现有一瓶由NH4+、Cl-、NO3-、CO32-、SO42-、SO32-、OH-等离子中的某几种组成的混合物。用A、B、C三支试管,各取少量该混合液,分别进行如下实验:
(1)向试管A中滴加Ba(NO3)2溶液,有白色沉淀析出。
(2)向试管B中加入稀HNO3至溶液呈酸性,有无色气体冒出。继续加入AgNO3溶液或Ba(NO3)2溶液,均无沉淀生成。
(3)取试管C滴加几滴酚酞试液,溶液呈红色,再加入Cu片和浓H2SO4共热,一段时间后,试管口冒红棕色的气体。
根据上述实验现象推断,原溶液中可能含有 离子,一定不可能含有 离子。
解析 这是一道考查离子鉴定知识的分析推断题。试题给出了一些离子和实验过程,要求学生能从离子的特征反应和离子大量共存的条件入手,进行分析、推断。既考查了学生对有关离子反应和现象特征的掌握,又考查了学生分析、推理、判断能力。首先应该分析题中给出的离子是否能大量共存,其中NH4+和OH-之间能发生反应:NH4++OH-=NH3·H2O,所以不能大量共存。根据(3)酚酞红色,说明溶液呈碱性,即含有OH-而不应含有NH4+。又据(3)中加浓H2SO4和Cu共热,生成红棕色NO2气体,因此推知含有NO3-。根据(2)加HNO3生成气体,说明可能有CO2和SO2。当HNO3过量时,加AgNO3或Ba(NO3)2溶液无沉淀,说明无Cl-和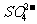 ,也可推知不含
,也可推知不含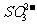 (因
(因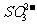 与HNO3反应生成
与HNO3反应生成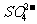 )。最后由(1)推知原混合物中还有
)。最后由(1)推知原混合物中还有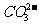 ,因Ba2+和
,因Ba2+和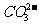 生成BaCO3沉淀。
生成BaCO3沉淀。
答案:OH-,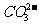 -,NO3-;Cl-,NH4+,
-,NO3-;Cl-,NH4+,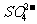 ,
,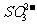 。
。
[变式]对某酸性溶液(可能含有Br-、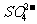 、H2SO3、NH4+)分别进行如下实验:
、H2SO3、NH4+)分别进行如下实验:
(1)加热时放出的气体可以使品红溶液褪色。
(2)加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝。
(3)加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀HNO3。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
答案:B
[例2]Cu+在酸性溶液性质不稳定,可发生自身氧化还原生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3溶液及pH试纸,而没有其它试剂,简述如何用最简便的方法来检验CuO经H2还原所得的红色产物是否含有碱性氧化物Cu2O。
解析 该题是利用信息对还原产物组成的证明,关键是理解Cu2O发生自身氧化还原反应而生成Cu2+和Cu,故不能选浓硫酸、硝酸、FeCl3溶液。应利用信息检验产物能否在酸性溶液中产生Cu2+,但不能是被氧化剂氧化而生成的Cu2+。
答案:取少许红色产物,加入稀硫酸振荡,若溶液变为蓝色,说明产物中有Cu2O; 若溶液不变色,说明产物中无Cu2O。
[例3]消除碘缺乏病的有效措施之一,就是在食盐中加入一定量的KIO3。已知在溶液中IO3-可与I-发生反应:IO3-+ I-+6H+=3I2+3H2O.根据此反应,可用试纸和一些生活中常见的物质进行检验,证明食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒,⑧食用油。请写出证明食盐中存在IO3-的实验步骤(仪器部分免述)。
解析:这是一道涉及日常生活的设计性实验题,根据题意及化学方程式可知,该实验除需提供食盐样品外,还应供给水、淀粉、I-及H+等。
能满足上述要求的玄宫物质有①自来水、③碘化钾淀粉试纸、④淀粉、⑥食醋。但自来水中含有Cl2、HClO等氧化性杂质,易将I-氧化为I2,造成判断失误,故自来水不能使用。碘化钾淀粉试纸能提供I-及淀粉。食醋的主要成分是含3%-5%醋酸的溶液,既含水,又含H+,一举两得。因此实验时,必须使用的物质是:碘化钾淀粉试纸、食醋、何食盐(样品)。
答案: ①将少量食盐溶解在食醋中,制成溶液;②用玻璃棒蘸取上述溶液,滴在碘化钾淀粉试纸上,若试纸变蓝色,说明食盐中含有IO3-。
[例4]有7瓶有机物A、B、C、D、E、F、G,它们可能是苯、甲苯、己烯、苯酚、乙醇、乙醛、乙酸,为确定每瓶成分,进行下列实验:
①取7种少量有机物,分别加水,振荡后与水分层的是A、D、G;
②取少量A、D、G分别加入溴水,振荡后,只有D不仅能使溴水退色,而且油层也无色;
③取少量A、G,分别加入酸性KMnO4溶液,振荡后,G能使酸性KMnO4溶液退色;
④取A少量,加浓H2SO4和浓HNO3,加热后倒入水中,有苦杏仁味油状液体生成;
⑤取少量B、C、E、F,分别加入银氨溶液,经水浴加热后,只有B出现银镜;
⑥取少量C、E、F,若分别加入金属Na,均有H2放出;若分别加入Na2CO3溶液;只有F有气体放出;
⑦取少量C、E,滴入FeCl3溶液,E溶液呈紫色;
⑧取少量C、F,混合后加浓H2SO4,加热后有果香味的油状液体生成。
试推断A、B、C、D、E、F、G各是什么物质?
解析:物质的实验推断,也属于物质的检验类试题。对于较大的实验推断题,不可能每一步都能得出结论,因此需要将每一步的结论写出,最后组合各步结论,可以得出答案。
由①可知:A、D、G可能是苯、甲苯和己烯,不可能为苯酚,因为所取有机物为少量。
由②可知:D应是己烯,因烯烃可与溴水发生加成反应。
由③④可知:G为甲苯,而A则为苯。
由⑤可知:B中含有-CHO,所以B是乙醛。
由⑥可知:F是乙酸,因为只有乙酸可与Na2CO3反应,而放出气体。
由⑦⑧可知:E为苯酚,因苯酚遇FeCl3溶液而呈紫色,C则为乙醇。
答案:A、B、C、D、E、F、G分别为苯、乙醛、乙醇、己烯、苯酚、乙酸、甲苯。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com