
(二)加强区域内部经济联系(即经济区域化),是走向经济全球化的阶梯
1.在相对独立的经济区内,各国由于交往便利,经济联系密切,易于找到利益的共同点,
从而达成某种协议,建立某种一体化组织。
2.一些大国为了在世界市场中抢占更多的份额,需要以各自建立的一体化组织为依托,极
力扩大势力范围,实现竞争优势。
3.面对发达国家的竞争和不合理的国际经济秩序,发展中国家需要加强相互间的政治协调
和合作,推动区域一体化进程,以集团姿态迎接经济全球化的挑战。
问题讨论 --
①区域经济一体化与世界经济全球化的关系?二者是否存在矛盾?
②对于建立区域经济集团,发展中国家与发达国家的出发点有何不同?
①答:区域经济一体化是走向经济全球化的阶梯、是全球化的基础、是全球化的阶段性表现。而全球化是区域经济一体化发展的结果。二者之间应该没有矛盾,但应注意一些组织盲目排外、对发展中国家要求苛刻、不合理制裁等倾向。
②答:发达国家的出发点为了在区域中占据主导地位,排斥其他大国,极力扩大势力范围,实现竞争优势。而发展中国家则是通过联合加强自身的影响,以集团姿态迎接经济全球化的挑战。
(一)区域性经济合作组织的产生背景及其特征
背景 -- 第二次世界大战以后,全球经济联系日益密切,竞争越发加剧。
特征 -- 区域性经济合作组织一方面具有内向的保护性,另一方面具有外向的竞争性。在集团内部,成员国之间实行关税互惠,取消贸易壁垒,组成共同市场,实现经济互补合作,推动区域经济一体化。
问题:举例说明区域性经济合作组织具有内向的保护性以及具有外向的竞争性。
答:内向的保护性 -- 如20世纪70年代发生的“石油危机”。当时石油输出国组织为对抗西方发达国家,而采取石油提价的措施,以石油为武器,保护自己的利益。
外向的竞争性 -- 如欧盟在内部实行联合、进行优势互补,从而降低生产成本,使它们的产品在国际上有较强的竞争力。
碳酸钠的水合:Na2CO3 + x H2O === Na2CO3·x H2O
碳酸钠晶体的风化:Na2CO3·x H2O === Na2CO3 + x H2O
 碳酸氢钠受热分解:2NaHCO3===Na2CO3
+H2O+ CO2 ↑
碳酸氢钠受热分解:2NaHCO3===Na2CO3
+H2O+ CO2 ↑
碳酸钠溶液中通入二氧化碳:Na2CO3 +CO2 +H2O === 2NaHCO3
CO32- +CO2 +H2O === 2HCO3-
碳酸氢钠溶液中加入氢氧化钠:NaHCO3 +NaOH ===Na2CO3 +H2O
HCO3- +OH-===CO32- +H2O
碳酸氢钠中加入盐酸:NaHCO3 + HCl === NaCl + CO2 ↑ + H2O
HCO3- + H+ === CO2 ↑ + H2O
碳酸氢钠溶液中加入硫酸氢钠:NaHCO3 + NaHSO4 === Na2SO4 + CO2 ↑ + H2O
HCO3- + H+ === CO2 ↑ + H2O
 铁高温下与水蒸气反应:3Fe + 4H2O(g)====Fe3O4 + 4H2
铁高温下与水蒸气反应:3Fe + 4H2O(g)====Fe3O4 + 4H2
氢氧化亚铁易被空气中氧气氧化:4 Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
 Fe(OH)3 不稳定:2 Fe(OH)3 ==== Fe2O3 + 3 H2O
Fe(OH)3 不稳定:2 Fe(OH)3 ==== Fe2O3 + 3 H2O
2FeCl3 + Fe == 3FeCl2 2Fe3+ + Fe == 3Fe2+
2FeCl2 + Cl2 ==2FeCl3 2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
FeCl3 溶液溶解Cu : 2FeCl3 +Cu == 2FeCl2 + CuCl2 (2Fe3+ +Cu == 2Fe2+ + Cu2+)
2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑ 2Al + 2OH-+ 2H2O ==2AlO2-+3H2↑
2Al + 6HCl == 2AlCl3 + 3H2↑ 2Al + 6 H+== 2Al3++3H2↑
Al2O3 + 6HCl == 2AlCl3 + 3 H2O Al2O3 + 6 H+== 2Al3+ + 3 H2O
Al2O3 + 2 NaOH== 2NaAlO2 + H2O Al2O3 + 2OH- ==2AlO2- + H2O
Al (OH)3 + 3 HCl == AlCl3 + 3 H2O Al (OH)3 + 3 H+== Al3+ + 3 H2O
Al (OH)3 + NaOH == NaAlO2 + 2 H2O Al (OH)3 + OH- ==AlO2- + 2 H2O
氢氧化铝的实验室制法 :铝盐溶液和氨水反应制取氢氧化铝
Al2(SO4)3 + 6 NH3·H2O == 2 Al (OH)3↓+ 3(NH4)2SO4
(离子方程式:Al3+ + 3NH3·H2O== Al (OH)3↓+3NH4+)
Al (OH)3 不稳定:2 Al (OH)3 ==== Al2O3 + 3 H2O
2Na +2H2O ====2NaOH + H2↑ 2Na+2H2O === 2Na++ 2OH-+ H2↑
4Na +O2 ==== 2Na2O
 2Na +O2 ==== 2Na2O2
2Na +O2 ==== 2Na2O2
2Na2O2 +2H2O === 4NaOH +O2↑ 2Na2O2+2H2O === 4Na+ + 4OH-+O2↑
2Na2O2 +2CO2 === 2Na2CO3 + O2
Na2O + H2O === 2NaOH Na2O + H2O === 2Na+ + 2OH-
14.将一定量的NaOH与NaHCO3的混合物X,放在密闭容器中加热,充分反应后生成CO2气体V1 L(V1 ≠ 0)。将反应后的固体残渣Y与过量盐酸反应,又生成CO2 V2 L(气体体积均在标准状况下测定)。
(1)Y的成分是_______________。
A.Na2CO3与NaOH B. Na2CO3与NaHCO3 C. 只含有Na2CO3 D.只含有NaOH
(2)X中NaOH与NaHCO3共__________mol;NaOH与NaHCO3物质的量之比为_______。
第三章有关反应方程式总结
13.氢氧化亚铁的制备方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_____________;
(2)除去蒸馏水中溶解的O2常采用__________的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是______ _________。
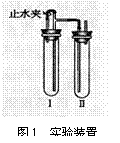 方法二:在如图1装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。
方法二:在如图1装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。
(1) 在试管I中加入的试剂是________________;
(2)在试管Ⅱ里加入的试剂是_________________;
(3)为了制得Fe(OH)2白色沉淀,在试管I和Ⅱ中加人试剂,打开止水夹,
塞紧塞子后的实验步骤是______________;
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________ ____________。
12.如何除去下列物质中含有的少量杂质?
(1)Na2CO3中混有NaHCO3
(2) NaHCO3溶液中混有Na2CO3
(3) Na2CO3中混有Na2O2
(4)NaCl溶液中混有NaHCO3
(5)CO2中混有HCl气体
(6)NaOH溶液中混有Na2CO3
11.有由Na2CO3、NaHCO3、NaCl中的某几种物质组成的混合物,向混合物中加入足量盐酸有气体放出,若将上述混合物在空气中充分加热,也有气体放出,下列推断正确的是( )
A.混合物中一定含有Na2CO3 B.混合物中一定不含有Na2CO3和NaCl
C.混合物中是否含有Na2CO3和NaCl无法确定 D.混合物中一定不含有NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com