
题目:海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:


(1)在虚线框内画出实验操作①的仪器装置示意图(见题后说明)。实验操作③的名称是_____________,所用主要仪器名称为_____________。
(2)提取碘的过程中,可供选择的有机试剂是__________________________ (填序号,多选扣分)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量(填序号) _____________溶液,反应的离子方程式为__________________________
A.KI03 B.HCIO C.KI D.Br2
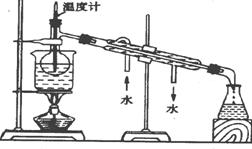
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)
① _______________________②________________③_________________④_____________
(5)实验中使用水浴的原因是__________________________,
最后晶体碘聚集在_________(填仪器名)中
 说明:实验装置中仪器用下面方法表示。铁架台、连接胶管等不必画出,如需加热在仪器下方用“△”表示。下列图示均为玻璃仪器,应标清液面或固体可视界面。
说明:实验装置中仪器用下面方法表示。铁架台、连接胶管等不必画出,如需加热在仪器下方用“△”表示。下列图示均为玻璃仪器,应标清液面或固体可视界面。
3.某化学课外小组用海带为原料制取了少量碘水。现以CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步。
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层。就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
→________→________→A→C→________→E→F
(3)选用CCl4从碘水中萃取碘的理由是_____________。
(4)下列物质,不能用作从碘水中萃取碘的溶剂是
A.热裂汽油 B.苯 C.酒精 D.正庚烷
2.海带中含碘元素,有人设计如下步骤来提取碘:
①通足量Cl2②将海带烧成灰,向灰中加水搅拌③加CCl4振荡④过滤⑤用分液漏斗分液。合理的操作顺序为
A.②→④→①→③→⑤
B.②→①→③→④→⑤
C;①→③→⑤→②→④
D.③→①→②→⑤→④
1.下列萃取和分液结合进行的操作(用煤油为萃取剂从碘水中萃取碘)中,错误的是( )(91年江苏师范招生试题)
A.饱和碘水和煤油加入分液漏斗中后,塞上口部的塞子,且一手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来用力振荡。
B.静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出;
D.最后再打开活塞,另用容器承接并保存上层液体。
21.(12分)在一定温度下,向一个容积不变的密闭容器中加入 2 molA 和 2 molB ,发生反应:2A(g) + B(g) 3C( g)
ΔH=-a
kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
3C( g)
ΔH=-a
kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是a b(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
A.温度和体积一定时,容器内压强不再变化
B.温度和体积一定时,某一物质浓度不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ω2 % (填“>”、“ =”或“<”),理由是 。
江西吉安一中2010-2011学年上学期高三开学模拟考试
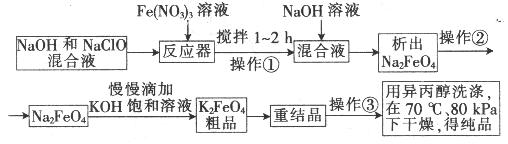
20.(12分)高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
试回答下列问题
(1)操作①搅拌的目的是: 。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)
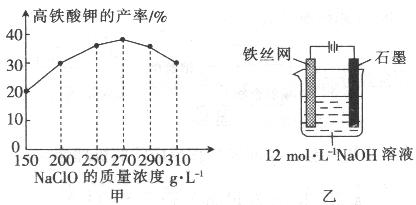
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
19. (9分) 已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它会自动脱去一分子水生成含有羰基的化合物。化合物A为苯的同系物,aLA的蒸汽完全燃烧消耗相同状况下O2 9aL。关于A的一系列转化关系如图所示。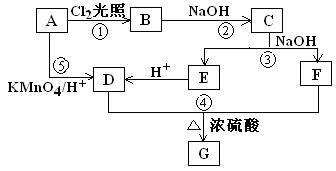
其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F。回答有关问题
(1)反应①②③④⑤中,不属于取代反应的有___________________(填序号)。
(2)B是反应①的产物之一,写出反应①的其他可能产物中摩尔质量为195.5g/mol的结构简式__________________。
(3)写出反应④的化学方程式_____________________________________。
(4)G属于芳香酸苯酚酯类的同分异构体有______种,写出其中任意一种的结构简式____________。
18. (10分)2007年诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机制。T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1(注:图中“吸”表示在催化剂表面的吸附)。请回答下列问题:
(1)合成氨反应的机理为
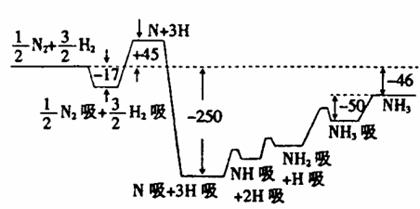
①
②N2 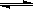 N2吸
N2吸 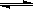 2N
2N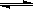 2N吸
2N吸
③N吸+H吸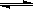 NH吸
NH吸
④NH吸+H吸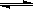 NH2吸
NH2吸
⑤NH2吸+H吸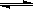 NH3吸
NH3吸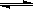 NH3
NH3
(2)T=673K,合成氨反应的热化学方程式为 。
(3)液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3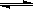
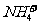 +
+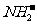 (某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=_________________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物。它易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_________________。
17.(9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)
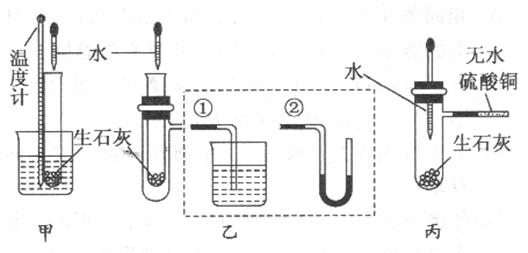
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
16.某温度下,向一洁净干燥的烧杯中加入56gFe粉,然后加入400
mL 16 浓HNO3,反应过程中产生气体的体积和反应时间的关系如图所示,最后固体全部溶解,气体体积均在标准状况下测定。假设反应中HNO3的还原产物只有NO和NO2,那么理论上从哪一时刻开始产生NO( )
浓HNO3,反应过程中产生气体的体积和反应时间的关系如图所示,最后固体全部溶解,气体体积均在标准状况下测定。假设反应中HNO3的还原产物只有NO和NO2,那么理论上从哪一时刻开始产生NO( )
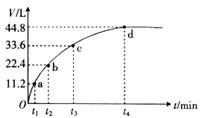
A.t1 B.t2 C.t3 D.t4
第Ⅱ卷(非选择题52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com