
28、(6分)

|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
C |
B |
C |
B |
B |
C |
C |
C |
D |
D |
A |
D |
D |
|
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
|
A |
D |
B |
A |
A |
B |
D |
C |
A |
A |
D |
A |
A |
27、(4分)NO,3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
33、(8分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

2)整个过程中的还原剂是 。
3)把KI换成KBr,则CCl4层变为_ _色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
4)加碘盐中含碘量为20mg-50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
2010年杭西高高三化学开学考答案
32、(10分)某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
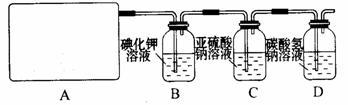
试回答:
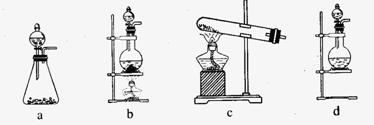
(1)该实验中A部分的装置是 (填写装置的序号)。
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式 。
(4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g ,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:
31、(4分)已知CO和CO2的混合气体14.4g在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为_____g,CO2的物质的量为_____mol。
29、(8分)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g· mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。 (2)该气体所含原子总数为_______ 个。
(3)该气体在标准状况下的体积为_________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______ 。 30、(8分)实验室要配制1mol/L的稀硫酸250mL,回答下列问题: (1)需要98%密度为1.84g/cm3的浓硫酸 mL (2)配制时,必须使用的仪器有 (填代号) ①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶 ⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒 还缺少的仪器是 。 (3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。 (4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”) ①没有洗涤烧杯和玻璃棒。 。 ②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。 ③容量瓶没有干燥。
28、(6分)有一瓶澄清溶液,可能含有NH+4、K+、
Mg2+、Ba2+、Al3+、Fe3+、SO2― 4、CO2― 3、NO― 3、Cl―、I―现进行如下实验:
(1)测知溶液显强酸性;
(2)取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
(3)另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
(4)取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
(5)将实验(3)中的碱性溶液加热,有气体放出,该气体能使湿红色石蕊试纸变蓝。
问:①原溶液中肯定存在的离子是____________________;
②肯定不存在的离子是______________________________;
③不能确定是否存在的离子是______________________________。
27、(4分)将铜片投入盛有稀硫酸的试管中无反应。当加入少量硝酸钾晶体后,试管内产生一种无色气体,这种气体在试管口变成红棕色。这种无色气体是__________。写出有关的离子反应方程式.________________________________________________________
26、已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是 PbSO4+2CH3COONH4==Pb(CH3COO)2+(NH4)2SO4。当在Pb(CH3COO)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成。表示这个反应的有关离子方程式正确的是
A.Pb(CH3COO)2+H2S==PbS↓+2CH3COOH
B.Pb2++H2S==PbS↓+2H+
C.Pb2++2CH3COO-+H2S==PbS↓+2CH3COOH
D.Pb2++2CH3COO-+2H++S2-==PbS↓+2 CH3COOH
25、被称为万能还原剂的NaBH4溶于水并和水发生反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.被氧化的元素与被还原的元素质量比为1︰1 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D. NaBH4既是氧化剂又是还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com