
3、写出下列反应的化学方程式,并说明反应中反应物和生成物的物质的量的关系。
(1)氢氧化钠和硫酸的反应。
(2)氧化铁在高温下与一氧化碳的反应。
(3)氯酸钾(KClO3)加热分解生成氧气和氯化钾的反应。
(4)过氧化氢(H2O2)分解成氧气和水的反应。
[师]巡视,观察学生完成情况。
[学生活动]学生汇报练习结果,教师点评。
2、根据上述计算,归纳物质的量(n)与物质的质量(m)、物质的摩尔质量(M)之间的关系 。
[学生活动]讨论,总结练习1的思考方式,找出关系式。
[板书]2、数学表达式: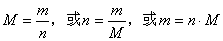
[问题解决3]
1、参考下列解题方式,完成下列计算:
(1)9.8 g H2SO4的物质的量 。(0.1 mol)
(2)10.6 g Na2CO3的物质的量 。(0.1 mol)
(3)0.25 mol CaCO3的质量 。(25 g)
(4)2.0 mol H2O的质量 。(36 g)
[师]巡视,观察学生完成情况。
[学生活动]学生汇报练习结果,教师点评。
[师]请同学们完成“问题解决2”
[问题解决2]
1、定义:1mol任何物质的质量,称为该物质的摩尔质量。
用符号:M表示,常用单位为g·mol-1
[师]请同学们完成下列练习。
[问题解决]
5、1个水分子中有 个电子,1 mol H2O中呢?
[投影练习答案略]
[板书]二、摩尔质量
4、1 mol HCl溶于水,水中存在的溶质粒子是什么?它们的物质的量各是多少?
3、1 mol H2SO4中含有 个H2SO4分子, 个硫酸根离子。
2、2 mol水中含有 个水分子, 个氢原子。
1、0.5 mol水中含有 个水分子。
3、 NA个水分子的物质的量是多少?(已知,阿伏加德罗常数为NA)
[投影练习答案略]
教师引导学生总结得出:粒子总个数、阿伏加德罗常数、物质的量三者的关系为:
[板书]5.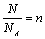
[讲解]摩尔是一个巨大数量粒子集合体,可以有0.5 mol O2,0.01 mol H2SO4等,而分子、原子等,就不能说0.5个或0.01个。
[投影练习]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com