
9、19世纪中期,资本主义列强对外扩张不断加剧,其基本的推动力是
A.资本主义制度的确立 B.工业资本主义的发展
C.世界联系的不断加强 D.资产阶级力量的壮大
8、被美国学者保罗·肯尼迪誉为“挥动一只看不见的手,为工业革命的推进缔造了一个新的经济秩序”的经济思想是
A.亚当·斯密的自由竞争思想 B.马克思的政治经济学思想
C.凯恩斯的国家干预经济理论 D.欧文的空想社会主义思想
7、马克思说:“使小农转化为雇佣工人,使他们的生活资料转化为资本的物质要素的那些条件,同样也为资本建立了自己的国内市场。”最能体现马克思这一论述的事件是
A.奴隶贸易 B.英国的圈地运动
C.北美的种植园经济 D.西班牙对拉丁美洲的掠夺与经营
6、17-18世纪,欧美的主要资本主义国家先后进行了资产阶级革命,各国资产阶级革命中普遍具有的本质特征是
A.推翻了君主制度 B.彻底解决土地问题
C.向法制化国家过渡 D.建立民主共和制度
5、拉美独立后,大多数国家建立了资产阶级共和国,这表明
A.独立后大部分国家都完成了资产阶级革命
B.拉美革命在很大程度上受欧美革命的影响
C.独立后资本主义得到迅速发展
D.欧洲移民起了领导作用
4、法国资产阶级革命时期,君主立宪派当政时完成的历史任务是
A.废除封建土地所有制和封建义务 B.推翻君主制成立共和国
C.废除封建君主专制和等级制度 D.推行全面限价法令
3、18世纪,中国文化在西欧得到进一步发展,特别推崇中国的儒家思想,曾在他的著作中对中国文化进行过专门论述的思想家是


2、马克思说,启蒙思想家“已经用人的眼光来观察国家,并且从理性和经验中而不是从神学中引申出国家的自然规律”,其中“理性”的含义是
A.独立的思考与自主的精神 B.君主的权力与党派的信仰
C.国家的意志与精神的寄托 D.权威的判断与历史的传统
1、新航路的开辟对中国的直接影响是
A.中国开始沦为半殖民地半封建社会
B.葡萄牙殖民者占领了我国澳门
C.香港被英国占领
D.中国封建统治者逐步实行闭关锁国政策
14、 T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
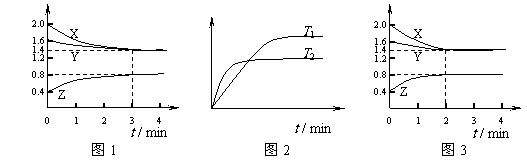
A.容器中发生的反应可表示为:3X(g)+Y(g) 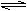
 2Z(g)
2Z(g)
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.反应进行的前3min内,用X表示的反应速率 v(X)=0.10mol•(L•min) -1
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂。

非选择题(共78分)
15(12分)、氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:
 根据上述流程回答下列问题:
根据上述流程回答下列问题:
⑴混合①中发生反应的化学方程式为 ▲ 。
⑵混合①中使用冰水的目的是 ▲ 。
⑶操作Ⅱ和操作Ⅲ的名称分别是 ▲ 、 ▲ 。
操作Ⅲ一般适用于分离_____▲_____混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
⑷混合②中加入Na2SO3的目的是 ▲ 。
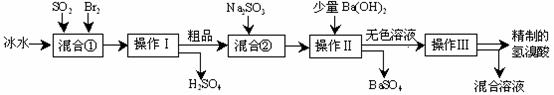
16(12分)、工业上制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
⑴KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是 ▲ (填代号)。
a. NaClO溶液 b. 双氧水 c. 苯酚 d. 75%酒精
⑵高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是___▲__(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
⑶上述流程中可以循环使用的物质有 ▲ 、 ▲ (写化学式)。
⑷若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 ▲ mol KMnO4。
⑸该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2(不必进行净化处理),所需试剂最好选择(选填代号) ▲ 。
a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱
17(12分)、甲醇是一种可再生能源,具有广泛的开发和应用前景。
⑴工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g)
CH3OH(g) +
H2O(g)  ΔH2
ΔH2
① 上述反应符合“原子经济”原则的是 ▲____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度[ |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 ▲ 0 (填“>”、“=”或“<”=。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ▲ ,此时的温度为 ▲ (从上表中选择)。
⑵已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③  H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
 写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
▲
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
▲
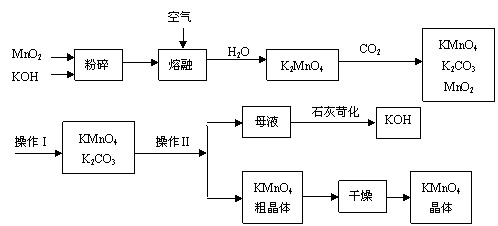
⑶某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:则该电池正极的电极反应为: ▲ 。
18(10分)、氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂。以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图。
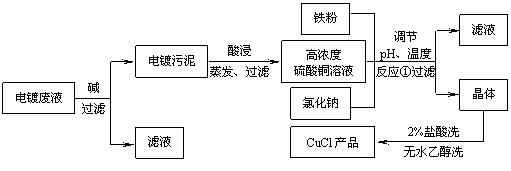

 下图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系。
下图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系。

 试填空。
试填空。
 (1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:
▲ 。
 (2)由反应①制备CuCl时的最佳pH在 ▲ 左右。
(2)由反应①制备CuCl时的最佳pH在 ▲ 左右。
 (3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有 ▲
的特性。
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有 ▲
的特性。
 (4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为: ▲ 。
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为: ▲ 。
如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为: ▲ 。
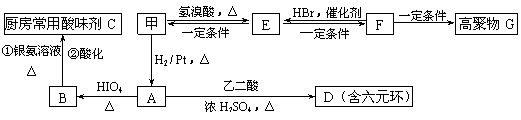
19(10分)、某有机物X的相对分子质量小于100,1mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2112L。
⑴该有机物X的分子式为 ▲ 。
a.C4H8 b.C2H4O c.C4H8O2 d.C10H20O20
⑵甲物质是X的同分异构体,分子中含有羰基和羟基,物质甲能发生如下图所示的转化:
已知: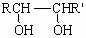
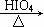 RCHO + R’CHO
RCHO + R’CHO
①B的名称是 ▲ 。
②A→D的反应类型为 ▲ ,E→F的反应条件是 ▲ 。
③写出F→G的化学方程式: ▲ 。
⑶物质乙也是X的同分异构体,1mol乙与足量的Na反应可生成1molH2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上。乙的核磁共振氢谱图中有3个峰,面积比为2∶1∶1。PBS是一种新型生物降解塑料,其结构简式为: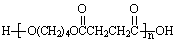
请设计合理方案以乙为原料(无机试剂自选)合成PBS(用合成路线流程图表示,并注明反应条件)。提示:可利用本题⑵中的信息。
20(10分)、如图横坐标为溶液的pH,纵坐标为Zn2+ 离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题。

⑴往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 ▲ 。
⑵从图中数据计算可得Zn(OH)2的溶度积(Ksp)= ▲ 。
⑶某废液中含Zn2+ 离子,为提取Zn2+ 离子可以控制溶液中pH的范围是 ▲ 。
⑷往1L 1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ▲ mol (精确到小数点后2位)。
21(12分)、有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区。A、E的原子最外层电子数相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
⑴写出下列元素的符号:D ▲ ,G ▲ ;
⑵D的前一元素第一电离能高于D的原因: ▲ ;
⑶由A、B、C形成的ABC分子中,含有 ▲ 个σ键, ▲ 个π键;
⑷由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 ▲
(写化学式),原因是 ▲ ;
⑸在DF42-中,中心D原子的杂化方式为 ▲ ;短周期元素中形成的微粒与DF42-等电子体的有很多,如 ▲ 、 ▲ (离子、分子各举一例)等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com