
24.(1)某混合气体中可能含有N2、O2、Cl2、HCl、NH3、NO、NO2中的两种或多种气体,现将此无色透明的混合气体通过浓硫酸后,气体体积明显减小,当剩余气体与空气接触时,立即变为红棕色,则原混合气体中一定含有的气体是 ,一定不存的气体是 ,可能存在的气体是 。
(2)将标准状况下一定体积的CO2气体缓慢通入V L NaOH溶液中,结果CO2和NaOH均无剩余.在反应后的溶液中加入足量的澄清石灰水得到W g沉淀.据以上数据能否确定CO2的体积?若能,请用上述数据求出CO2的体积.若不能,还需做什么实验?简要说明并运用实验测得的数据列式表示._________________________________________
23.某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
⑴该反应的氧化剂是
⑵如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在下面的化学式上用单线桥法标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
22.下列操作或发生事故时的处理方法正确的是________(填字母)
A.将pH试纸用蒸馏水湿润后,测定稀盐酸的pH值
B.称量一定质量NaOH固体时,应将NaOH放在小烧杯中称量
C.配制一定浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线.
D.浓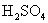 不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹3%-5%的小苏打溶液
不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹3%-5%的小苏打溶液
E.使用酒精灯时不慎倾倒在桌面上而失火,应立即用湿抹布盖灭
20.假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变。则下列推断不正确的是 A.此时16O的相对原子质量为32 B.标准状况下,44gCO2的体积为11.2L C.40gNaOH溶于水配成1L溶液,其物质的量浓度为1mol·L-1 D.44gCO2和28gCO含有相同数目的分子
18、在某100ml混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1. 92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L-1)是( )。
A.0.15 B.0.225 C.0.35 D.0.45
19.标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为 ( )
A.1:1:1 B.5:5:4YCY C.2:1:2 D.无法确定
18.把aL含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用bmol烧碱恰好把NH3全赶出,另一份与cmol BaCl2使SO42-完全沉淀。则原混合液中NO3-离子的物质的量浓度为
A.(b-2c)/a mol•L-1 B.(2b-4c)/a mol•L-1
C.(2b-c)/a mol•L-1 D.(b-2a)/a mol•L-1
17.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
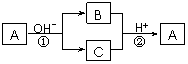
下列判断正确的是( )
A.X元素可能为Al B.X元素一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应
16.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I- = 2Fe2+ + I2
15.在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。
①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈黄色;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;
③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,
下列说法不正确的是
A.溶液中一定存在Br-、CO32- B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32- D.溶液一定呈碱性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com