
23、(8分)已知在酸性条件下,亚硝酸根(NO2-)的还原产物为 NO,氧化产物为 NO3-。现有①稀硫酸;②NaOH 溶液;③氨水;④KMnO4溶液;⑤KI淀粉溶液;⑥NaNO2溶液。
请选用合适的试剂来说明NO2-既有氧化性又有还原性。(已知:MnO4-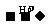 Mn2+)。
Mn2+)。
(1)说明 NO2-有氧化性,应选用的试剂是 (填数字序号),现象是 ,
反应的离子方程式是 。
(2)说明 NO2-有还原性,应选用的试剂是 (填数字序号),现象是 ,反应的离子方程式是 。
22、(10分)现有m g某气体,它由四原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为
(5)该气体溶于水后形成V L溶液,其溶液物质的量浓度为 mol·L-1。
21、有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物
和生成物,下列叙述错误的是
A.氧化剂与还原剂的物质的量之比为8︰l
B.还原产物为NH4+
C.若有l mol NO3-参加还原反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
第Ⅱ卷(非选择题 共58分)
20、已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
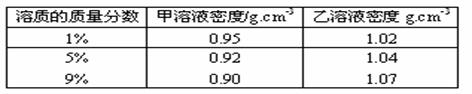
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
C.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
19、甲、乙两同学从同一溶液中各取出100g做如下实验:甲将溶液蒸发掉20g水后冷却到
室温,析出3.6g晶体(不含结晶水);乙将溶液蒸发掉30g水后冷却到室温,析出6.0g晶
体,若两同学实验都正确无误,则200g该溶液蒸发掉20g水后冷却到室温,析出晶体的质
量为
A.0 g B.2.4 g C.4.8 g D.9.6 g
18、水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH- Fe3O4+
S4O62-+2H2O,下列说法中,正确的是
A.x=2
B.参加反应的Fe2+全部做还原剂
C.每生成1mol Fe3O4,反应转移的电子总数为4mol
D.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
17、已知2Fe+3Br2=2FeBr3 2Fe3++2I―=2Fe2++I2 。现将Fe(NO3)2溶液分别滴入到①H2SO4 ②HNO3 ③溴水 ④碘水等溶液中,其中能使Fe2+变成Fe3+的是:
A、①②③④ B、只有②③ C、②③④ D、①②③
16、航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4 N2↑+4H2O+Cl2↑+2O2↑+Q,下列对此反应的叙述中错误的是
N2↑+4H2O+Cl2↑+2O2↑+Q,下列对此反应的叙述中错误的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
15、在热的稀硫酸中溶解了11.4克 FeSO4。当加入50毫升0.5mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy气体是
A、N2O B、NO C、N2O3 D、NO2
14、下列说法正确的是
A.能与酸反应生成盐和水的氧化物一定是碱性氧化物
B.把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用
C.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以AlO2-形式存在
D.在含有Cu(NO3)2、Mg(NO3)2、Fe(NO3)3溶液中加入适量锌粉,最先被还原的是Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com