
读某地等高线地形图,分析回答以下1-4题:
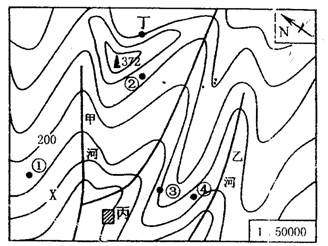
1、图中等高线X的数值最有可能是:
A.100m B.150m C.200m D.250m
6、SO42-:能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于盐酸。
小结:
 思维技巧点拨:
思维技巧点拨:
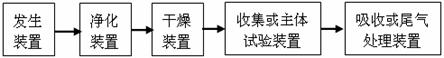
例1:如图装置可以用来发生、洗涤、干燥、收集气体。该装置可用于( )
A、浓硝酸和铜反应制备NO2
B、浓氨水和生石灰反应制备氨气
C、锌和盐酸反应制备氢气
D、碳酸钙和盐酸反应制备二氧化碳
答案:C
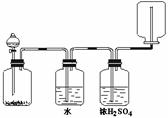
例2:某课外活动小组欲利用右图装置和下列试剂制取少量氧气、二氧化硫和氨气:
 A、浓H2SO4 B、浓盐酸 C、食盐
A、浓H2SO4 B、浓盐酸 C、食盐
D、MnO2 E、KClO3 F、H2O
G、浓氨水 H、Na2SO3 I、CaO
试用各试剂序号回答:
(1)若要制备少量氧气,应选择 。
(2)若要制备少量二氧化硫,应选择 。
(3)若要制备少量氨气,应选 。
答案:DF、AH、GI
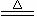
 例3:某研究性学习小组同学查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式Ca(ClO)2 + CaCl2 + 2H2SO4 2CaSO4
+ 2Cl2↑+ 2H2O,他们设计了如下图制取氯气并验证其性质的实验装置:
例3:某研究性学习小组同学查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式Ca(ClO)2 + CaCl2 + 2H2SO4 2CaSO4
+ 2Cl2↑+ 2H2O,他们设计了如下图制取氯气并验证其性质的实验装置:
请回答下列问题:
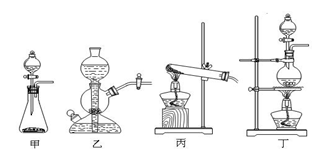 (1)该实验中A部分的装置是
(1)该实验中A部分的装置是
(填写装置的序号)。
(2)A中发生反应一段时间后,
B中的现象是 ;
整套实验装置存在的明显缺陷是
。
(3)写出D装置中发生反应的离子方程式 。
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
。
答案:(1)丁(2分) (2)溶液变蓝色(2分);无尾气吸收装置(2分)
(3)Cl2
+ H2O  H+ + Cl-+ HClO(2分) HCO3-+ H+ = H2O + CO2↑(2分)
H+ + Cl-+ HClO(2分) HCO3-+ H+ = H2O + CO2↑(2分)
(或Cl2 + HCO3-= Cl-+ HClO + CO2↑)
(4)取少量溶液置于洁净的试管中,向其中加入稀HCl至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠被氧化(3分)
例4:(2007高考天津11分)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
① 将干燥的氯气在110℃ - 140℃与硫反应,即可得S2C12粗品。
② 有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
|
S |
112.8 |
444.6 |
略 |
|
S2C12 |
-77 |
137 |
 遇水生成HCl、SO2、S;300℃以上完全 遇水生成HCl、SO2、S;300℃以上完全分解;S2C12 + C12 2SCl2 |
设计实验装置图如下:
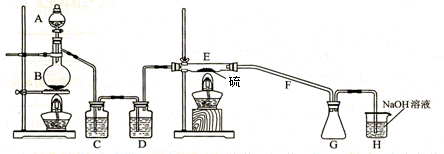
请回答下列问题:
(1)B中反应的离子方程式: ,
E中反应的化学方程式: ;
(2)C、D中的试剂分别是 、 ;
(3)仪器A、B的名称分别是 、 ,F的作用是 ;
(4)如果在加热E时温度过高,对实验结果的影响是 ,
在F中可能出现的现象是 ;
(5)为了提高S2C12的纯度,关键的操作是控制好温度和 ;
(6)上图装置不够完善,请你提出改进意见 。
答案:(1)MnO2+4H++2 C1- Mn2++ C12↑+ 2H2O 2 S + C12
Mn2++ C12↑+ 2H2O 2 S + C12 S2C12
S2C12
(2)饱和食盐水(或水), 浓硫酸 (3)分液漏斗,蒸馏烧瓶, 导气、冷凝;
(4)产率降低; 有固体产生(或其他正确描述) (5)控制浓盐酸的滴速不要过快 。
(6)用导管将A的上口和B相连(将A换成恒压漏斗);在G和H之间增加干燥装置。
作业布置:二轮材料P93:20.21
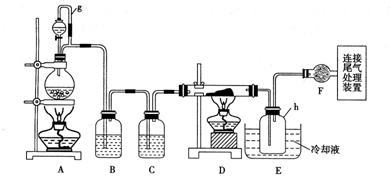 作业:(2009高考浙江28)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
作业:(2009高考浙江28)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a、四氯化硅遇水极易水解;
b、硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c、有关物质的物理常数见下表:
c、有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
 (1)写出装置A中发生反应的离子方程式
。
(1)写出装置A中发生反应的离子方程式
。
 (2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
(2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
 ①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由
。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol/LKMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
作业答案:: (1)MnO2 +
4H+ + 2Cl- Mn2+ + Cl2↑+ 2H2O
Mn2+ + Cl2↑+ 2H2O
(2)平衡压强,浓硫酸,使SiCl4 冷凝  (3)Al、P、Cl
(3)Al、P、Cl
(4) ①否;KMnO4溶液自身可作指示剂;  ②4.480%
②4.480%
5、Cl-:能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸。
4、Fe3+:能与 KSCN溶液反应,变成血红色 Fe(SCN)3溶液。
3、NH4+:铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
2、Ag+:能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀 HNO3。
1、Na+、K+:用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
通常有毒和有污染的尾气必须适当处理。常用经典仪器有:
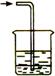




a b c d e
a用于NaOH吸收氯气、CO2;硫酸铜吸收H2S(气体溶解或反应速度不很快,不易引起倒吸);
b用于收集少量气体然后处理;c、d收集极易溶且溶解很快的气体。如HCl、HBr、NH3等;其中d 吸收量少。e用于处理难以吸收(有毒)且可燃的气体。如H2、CO等。
|
|
液态干燥剂 |
固态干燥剂 |
|
|
装置 |
 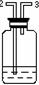 |
 |
 |
|
常见干燥剂 |
浓硫酸 |
无水氯化钙 |
碱石灰 |
|
可干燥气体 |
H2、O2、Cl2、SO2、CO2、CH4、N2、CO |
H2、O2、Cl2、SO2、CO2、CH4、N2、CO |
H2、O2、NH3、N2、CO、CH4 |
|
不可干燥气体 |
NH3、H2S、HBr、HI |
NH3 |
Cl2、H2S、HCl、SO2、CO2 |
(二)排气法:不与空气反应且密度与空气相差较大的气体;又可分为向上排空气法和向下排空气法。用排气法收集气体时,导气管一定要伸入集气瓶底部,把空气尽量排出。为了减少空气扩散,集气瓶口可盖上毛玻璃片(如图b);试管口轻轻塞上一小团疏松的棉花(如图d)
(1)向上排空气法:式量大于29的气体。如O2、CO2、SO2、H2S、Cl2、NO2(只用排空气)、HCl等;典型装置是b。
(2)向下排空气法:式量小于29的气体。如H2、CH4、NH3等;典型装置是c。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com