
3.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关叙述中正确的是( )
A.H2Y在电离时为:H2Y+H2O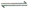 HY-+H3O+
HY-+H3O+
B.在该盐的溶液中,离子浓度为:C(Na+)>C(Y2-)>C(HY-)>C(OH-)>C(H+)
C.在该盐的溶液中,离子浓度为:C(Na+)>C(HY-)>C(Y2-)>C(OH-)>C(H+)
D.HY-水解方程式为:HY-+H2O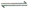 Y2-+H3O+
Y2-+H3O+
2.已知常温下有浓度为0.1mol.L-1PH=2的某一元弱酸HA溶液,;又知0.01mol·L-1
的一元碱BOH溶液中C(OH-)/C(H+)=1010,将上述两种溶液等体积混合,所得溶
液中离子深度大小关系正确的是 ( )
A.C(OH-)>C(H+)>C(B+)>C(A-) B.C(A-)>C(B+)>C(H+)>C(OH-)
C.C(B+)>C(A-)>C(OH-)>C(H+) D.C(B+)=C(A-)>C(H+)=C(OH-)
1、实验室中配制一种混合溶液,要使溶液中C(K+)=C(Cl-)=C(Na+)/2=C(SO42-),可选用的溶质可能是( )
A.KCl、Na2SO4 B.NaCl、K2SO4 C.NaCl、Na2SO4、K2SO4 D.KCl、Na2SO4、K2SO4
3、某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A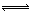 H++HA-;HA-
H++HA-;HA-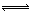 H++A2- 已知一级电离远大于二级电离,设有下列四种溶液:
A.0.01mol.L-1的H2A溶液
B.0.01mol.L-1的NaHA溶液( C(OH-)>C(H+) )
C.0.02mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
D.0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
H++A2- 已知一级电离远大于二级电离,设有下列四种溶液:
A.0.01mol.L-1的H2A溶液
B.0.01mol.L-1的NaHA溶液( C(OH-)>C(H+) )
C.0.02mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
D.0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) A溶液中各离子浓度大小为
B溶液中各离子浓度大小为
B溶液中可能存在的等式关为有
D溶液中各离子浓度大小为
D溶液中可能存在的等式关为有
(2) C(H+)最大的是______________________,最小的是______________________。
(3)C(H2A)最大的是______________________,最小的是______________________。 (4)C(A2-)最大的是______________________, 最小的是______________________。
[随堂作业]
2、现有NH4Cl和氨水组成的混合溶液C(填“>”、“<”或“=”)
①若溶液的pH=7,则该溶液中C(NH4+) C(Cl-);
②若溶液的pH>7,则该溶液中C(NH4+) C(Cl-);
③若C(NH4+)< C(Cl-),则溶液的pH 7。
1、在0.1mol/LNaHSO3溶液中存在着微粒浓度的关系式,正确的是
A.C(Na+)>C(HSO3-)> C(SO32-)> C(H+)>C(OH-)
B.C(Na+)+C(H+)= C(HSO3-)+ C(SO32-)+C(OH-)
C.C(Na+)+C(H+)=C(HSO3-)+2C(SO32-)+ C(OH-)
D.C(Na+)= C(HSO3-)+C(SO32-)+ C(H2SO3)
3、质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:C(H3O+)+C(H2CO3)=C(NH3)+C(OH-)+C(CO32-)。
[巩固]
2、物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nC(Na+):nC(C)=1:1,推出:C(Na+)=C(HCO3-)+C(CO32-)+C(H2CO3)
1、 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:nC(Na+)+nC(H+)=nC(HCO3-)+2nC(CO32-)+nC(OH-)推出:C(Na+)+C(H+)=C(HCO3-)+2C(CO32-)+C(OH-)
3、物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3
⑤NH4HCO3,按C(CO32-)由小到大排列顺序正确的是 ( )
A.⑤④③②① B.③⑤②④① C.③②⑤④① D.③⑤④②①
题型二
[例3]把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( ) A.C(CH3COO-)>C(Na+) B.C(CH3COOH)>C(CH3COO-) C.2C(H+)=C(CH3COO-)-C(CH3COOH) D.C(CH3COOH)+ C(CH3COO-)=0.01mol/L
[点拨]此题实质上是0.05mol/L的CH3COOH溶液和0.05mol/L的CH3COONa溶液的混合溶液。由电荷守恒关系可得: c(H+)+c(Na+)=c(CH3COO-)+c(OH-) (1)
由物料守恒关系可得: c(CH3COOH)+c(CH3COO-)=c(Na+)×2=0.01mol/L (2) 由(2)可知D正确。 将(1)×2+(2)可得: 2c(H+)=c(CH3COO-)+2c(OH-)-c(CH3COOH)(3)C选项错误。
[例4]用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-) B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-) D.C(CH3COO-)+C(OH-)=0.2 mol/L
[点拨] CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知C(CH3COO-)>C(Na+),根据电荷守恒C(CH3COO-)+C(OH-)=C(Na+)+C(H+),可得出C(OH-)<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。
[规律总结]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com