
3. 圆x2+y2-2x=0和x2+y2+4y=0的位置关系是( )
A. 相离 B. 外切 C. 相交 D. 内切
2. 如果直线l将圆x2+y2-2x-4y=0平分,且不通过第四象限,那么直线l的斜率的取值范围是( )
A. [0,2] B. [0,1]
C. [0,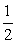 ] D. [0,
] D. [0,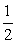 )
)
1. (’06安徽文,7)直线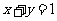 与圆
与圆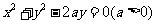 没有公共点,则
没有公共点,则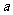 的取值范围是( )
的取值范围是( )
A. 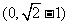 B.
B. 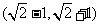 C.
C. 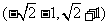 D.
D. 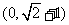
17.Fe、Fe2O3和CuO组成的混合物投入110mL 4mol/L的盐酸中,充分反应后,生成H2896mL(标准状况),溶液中除尚留有1.28g固体外全部是FeCl2,过滤后将滤液稀释至200mL,从中取出50ml,逐滴加入1mol/L的NaOH溶液,当加到20mL时,开始出现沉淀,求混合物中各物质的质量分数?
16.将10g铁粉置于40mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792L标准状况下的混合气体(NO2、NO),溶液里还残留4.4g固体。
(1)求该反应中被还原的硝酸与未被还原的硝酸的质量比。
(2)求理论上原硝酸的物质的量浓度。
(3)求混合气体中NO2、NO的体积比。
(4)写出上述反应的总的化学方程式。
15.某元素的氧化物很多,其中常见的有A、B两种。
(1)A为黄绿色气体,氧含量为47.44%,可用于漂泊木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为
(2)B为黄棕色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为
(3)你认为这两种气体是否可以在防SARS中作为消毒剂? (A、都可以
B、都不可以 C、只有气体A可以 D、只有气体B可以)
(4)写出气体A与NaOH反应的化学方程式
由于工业上大量使用的A具有爆炸性,A适宜存放在 (填“酸”或“碱”)性溶液中。
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式
14.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-→ CuI+ I3-
12. 有一种稀有气体化合物六铂氟酸氙XePtF6,研究报告指出:“关于XePtF6的电价有Xe2+[PtF6]2-、Xe+[PtF6]-两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6;加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。”试回答: (1)XePtF6中各元素的化合价分别是 、 、 。 (2)XePtF6是 (离子、共价)化合物。 (3)写出Xe与PtF6反应生成XePtF6的反应式 。而且O2与PtF6可发生类似反应,其反应式是 ,上述两反应属( ) A、均为氧化还原反应 B、均为非氧化还原反应 C、前者是氧化还原反应,后者是非氧化还原反应 13.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O
被氧化的元素是 __________ 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
11.一个完整的氧化-还原反应式可以折写成两个“半反应”,一个是氧化反应,另一个是还原反应;如2Fe3++Cu=2Fe2++Cu2+拆写的结果是:氧化反应:Cu-2e=Cu2+;还原反应:Fe3++e=Fe2+,据此,请将反应3NO2+H2O=2H++2NO3-+NO拆写成两个“半反应”式:
10.从含硒(Se)的废料中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸:2HCl+H2SeO4=H2SeO3+Cl2+H2O然后向亚硒酸中通入SO2,生成粗硒。进一步提纯时,可往熔融的粗硒中通入氧气,使生成的氧化硒挥发,再转变成亚硒酸,还原为单质硒。
根据上述信息,回答下列两题:
(1) 对盐酸与硒酸反应的下述判断中,正确的是
A.该反应是强酸制取弱酸的复分解反应 B.硒酸发生氧化反应
C.硒酸有强氧化性 D.盐酸在反应中是氧化剂
(2) 对SeO2和SO2及它们的水溶液,下列叙述不正确的是
A.SeO2和SO2均是酸性氧化物 B.SeO2和SO2均属于分子晶体类型
C.亚硫酸氧化性弱于亚硒酸 D.SO2与亚硒酸反应的物质的量比为1:1
(3)下列叙述正确的是
A.H2SeO3氧化性强于HNO3 B.亚硒酸氧化性强于H2SO3
C.二氧化硒的还原性强于二氧化硫 D.析出1mol硒,需H2SeO3、SO2各1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com