
17. (8分) 下面a-e是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托盘天平 e、温度计
①能够用以精确量取液体体积的是 (填写编号)
②使用容量瓶的第一步操作是___________________________________ 。
③若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是烧杯_________。
④若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
16.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下其充分反应后的固体,经测定无Na2O2剩余,则最后固体的物质的量为
A.1-4mol B.1-2mol C.2-4mol D.大于4mol
第Ⅱ卷(非选择题 共52分)
15.对反应O3+2KI+H2O===2KOH+I2+O2,下列说法正确的是
A. 在此反应中O3是氧化剂,O2是还原产物
B. 由此反应可知,氧化性强弱关系为:O3>I2>O2
C. 氧化产物与还原产物物质的量之比为1∶2
D.被还原的氧原子与被氧化的I-的个数比为1∶2
14.质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为
A.等于2c mol/L B.大于2c mol/L
C.小于2c mol/L D.在c mol/L∽2c mol/L之间
13.下列各组离子在溶液中按一定的物质的量之比(见括号)混合,所得溶液为无色透明,
且pH>7的是
A.Al3+、Cl-、Na+、CO32- (1∶3∶2∶1)
B.HCO3-、K+、H+、I- (1∶1∶1∶1)
C.Ca2+、K+、OH-、HCO3- (1∶1∶1∶2)
D.NH4+、Ba2+、OH-、Cl- (2∶1∶2∶2)
12.已知热化学方程式C2H2
(g) + 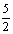 O2
(g)= 2CO2 (g) + H2O
(g);ΔH= -1256
kJ/mol,下列说法正确的是
O2
(g)= 2CO2 (g) + H2O
(g);ΔH= -1256
kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256 kJ /mol
B.若转移10 mol电子,则消耗2.5 mol O2
C.若生成2 mol 液态水,则ΔH = -2512 kJ/mol
D.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ
11.NA表示阿伏加德罗常数。下列说法中正确的是
A.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
B.6.2gNa2O和7.8gNa2O2混合物中所含有的阴离子数为0.3 NA
C.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
D.标准状况下,1 L辛烷完全燃烧生成的二氧化碳分子数为8/22.4NA
10.下列说法正确的是:
A.在氧化还原反应中,阴离子只能发生氧化反应
B.中和热是指1mol强酸和1mol强碱完全中和时所放出的热量
C.有些吸热反应不需要加热也能进行
D.酸、碱、盐、氧化物均为电解质
9.下列画有横线的物质,在反应中不能被完全消耗的是
①将含有少量H2O(g)的H2通过盛有足量Na2O2的容器中并不断用电火花点燃
②将1 molCu置于含2mol H2SO4的浓硫酸中加热
③1mol MnO2与含4mol HCl的浓盐酸加热反应
④在强光持续照射下,向过量的Ca(ClO)2溶液中通入少量CO2
A.①② B.②③ C.②④ D.③④
8.下列反应的离子方程式书写正确的是
A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B.氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
C.澄清的石灰水中加人过量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.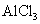 溶液中加入过量氨水:
溶液中加入过量氨水:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com