
1,丰富的煤炭资源
鲁尔区是在鲁尔煤田的基础上发展起来的,鲁尔煤田储量大,占全国总储量的3/4,其中具有经济开发价值的占全国储量的90%,煤质好,煤种齐全,含硫低,发热量高,开采条件好,并有漏天煤矿的分布。鲁尔区铁矿资源贫乏,但钢铁工业仍然十分发达。
2,离铁矿区较近:
通过陆上交通就近从法国东北部洛林铁矿区进口;后来又从瑞典、俄罗斯等国进口铁矿石到荷兰鹿特丹,再经过莱茵河运到鲁尔区,都依赖方便的交通,本区发展“移铁就煤型”工业。
3,便捷的水陆交通:
鲁尔区位于欧洲中部陆上交通的十字路口,陆上有稠密的铁路网和高速公路网,莱茵河,利珀河,鲁尔河等天然河流和四条人工运河,连成一体,并且都可通航,并能直达海洋,有着廉价方便的水运条件。这些河流不仅带来方便的交通,还为生产生活提供了充足的水源。
4,充沛的水源:
5,广阔的市场:
西欧的工业发达,为鲁尔区提供了广阔的市场。其鲁尔区本身既是生产中心,也是消费中心,以鲁尔区为中心,方圆100公里内,鲁尔区生产的70%以上的煤炭和钢铁在次加工,消费。
根据这些区位条件请同学们思考鲁尔区适合发展哪些工业?
学生答:煤炭,钢铁,电力,机械,(煤,水)化工,
鲁尔区是以采煤工业起家的工业区,过去的工业生产集中在这五大传统工业部门,其工业产值曾占到全国的40%,到20C50年为止,鲁尔区经历了一个世纪的繁荣,在次之后,经济开始衰落,并且是以煤炭工业和钢铁工业的衰落最为明显,为什么一个区位优势明显的工业区,最终走向了衰落呢?
1、铁合金
[投影]

[讲解]根据含碳量的不同,铁的合金分为生铁和钢。生铁的含碳量在2%-4%,还含有硅、锰及少量硫、磷等杂质,机械性能硬而脆,易断裂,可铸不可锻;钢中的含碳量一般在0.03%-2%之间,其它杂质含量也比生铁少,基本上不含硫和磷。机械性能比生铁优良,硬而韧,有弹性,延展性好,可铸可锻,易加工。
 [练习]1.生铁的含碳量在__之间,还含有等杂质,主要的机械性能__。钢的含碳量在__之间,与生铁比较其它杂质含量__,主要的机械性能__。
[练习]1.生铁的含碳量在__之间,还含有等杂质,主要的机械性能__。钢的含碳量在__之间,与生铁比较其它杂质含量__,主要的机械性能__。
[讲述]钢可以分为碳素钢和合金钢两大类,根据含碳量的不同。工业上一般把含碳量低于0.3%(质量分数)的叫做低碳钢;含碳量在0.3%-0.6%(质量分数)之间的叫做中碳钢;含碳量在0.6%(质量分数)以上的叫做高碳钢。合金钢是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种不同特殊性能,如强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀,以及其它许多优良性能。
[投影]不锈钢制品:

 [讲述]随着科学技术的进步和人民生活水平的提高,不锈钢的装饰品、餐具、炊具已经进入许多家庭。不锈钢制品外观光洁、美观,不易污染、不生锈,因此受到人们的青睐。
[讲述]随着科学技术的进步和人民生活水平的提高,不锈钢的装饰品、餐具、炊具已经进入许多家庭。不锈钢制品外观光洁、美观,不易污染、不生锈,因此受到人们的青睐。
不锈钢中除铁以外,还含有抗腐蚀性很强的铬和镍。铬的含量一般在13%以上,镍的含量也在10%左右。例如,有一种不锈钢的成分除铁以外,其他元素含量如下:
Cr(铬)17.0%-19.0%;Ni(镍)8.0%-11.0%; C(碳)≤0.14%;Si(硅)≤0.80%;Mn(锰)≤2.00%; P(磷)≤0.035%;S(硫)≤0.03%。
[练习]2.在下列物质名称后的括号内填上符合该物质的组成成分和用途的序号。
(1)低碳钢( ) (2)高碳钢( ) (3)不锈钢( ) (4)铸造生铁( )
A.含碳2%-4% B.含碳低于0.3% C.含碳高于0.6% D.含镍、铬
a.铸造铸件 b.机器零件 c.化工设备的耐酸塔 d.刀具
23.(共6分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
22、(4分)生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、嗅和味等。目前城市自来水处理过程中所使用的主要试剂仍是Cl2(消毒剂)和Al2(SO4)3(沉降剂),但由于种种原因,用这两种物质处理水质,总有缺陷。有资料报道:Na2FeO4(化合物中Fe呈+6价)是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+,因此使用该物质可代替Cl2和Al2(SO4)3。
⑴ 配平工业上制备铁酸钠的化学方程式:
Fe2O3+ NaNO3+ NaOH - Na2FeO4+ NaNO2+ H2O
⑵当反应物中含有1.4 mol Na+,且上述反应恰好完全进行时,电子转移总数为
NA。
21、(12分)根据下边反应框图填空。已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,F、G均能与L的水溶液反应放出B。

⑴ F的俗名是 。
⑵ 反应①~⑥中,属于氧化还原反应的是 。
⑶ 反应⑤的离子方程式为 。
⑷ 有一种单质能与H反应生成E,该反应的化学方程式为 。
⑸ 写出工业上制取M的化学方程式 ;
F中常混有少量M,如何检验M的存在? 。
20.(6分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
则原溶液中肯定存在的离子是_____________,肯定不存在的离子是________________
已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,再加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
19.(7分)水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)写出水的电子式 。
(2)A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:
;
;
。
18.(9分)已知漂白粉的有效成分能与浓盐酸反应生成Cl2和一种能作干燥剂的固体物质等。请从下图中选用适当的实验装置,设计一个最简单的实验,测定漂白粉有效成分的质量分数。
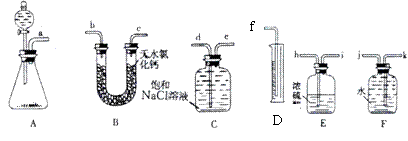

请填写下列空白:
(1)实验中漂白粉有效成分与浓盐酸反应的化学方程式为 。
(2)所选用装置的连接顺序应是(填各接口的字母代号) 。
(3)若各仪器内仍残留有少量Cl2,则测定结果将(填“偏高”、“偏低”或“不影响” ) ,其原因是 。
(4)某同学在实验中发现量筒里未收集到液体,其失败的原因可能是下列中的(填A、B、
C等代号) 。
①装置漏气 ②浓盐酸已变成稀盐酸 ③所选仪器容积太大
④漂白粉已全变质 ⑤e接f ⑥d接f
A.①②③ B.①②④⑤ C.①②④⑥ D.全部
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com