
3. Individual, Pair work & group work
Teaching Procedures:
Step 1 warming up
Talk about how many changes there have been in the last one thousand years. And what changes we might expect to find in the next one thousand years
Step two: pre-reading
you tell what problems people are facing today?
2. Asking and answering question activity
1. First and careful reading,
3. Enable the students to describe the life in the past, at present and in the future.
Difficult and Important Points:
Compare life in the past, at present and in the future
What is life in the future like? What changes will take place?
Teaching Methods:
2. Help the students to talk about life in the past, at present and in the future.
1. Learn some new words and expressions.
1. 学习并了解未来生活的各个方面用与现在生活的不同之处, 学习外星人的生活方式。
2)学习表示预测,建议的的句型。
(3)学习过去分词作定语和状语的结构。
(4)学习写好“report”,以训练学生的逻辑思维及写作能力.
The 1st Period
Teaching Aims:
12.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
|
项目 |
H2 |
N2 |
NH3 |
|
起始时 |
5 mol·-1L |
3 mol·-1L |
0 |
|
2 s末 |
2 mol·-1L |
|
|
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=____________。若此时
已达平衡,则可求得平衡常数为____________。
(2)如下图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是____________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6
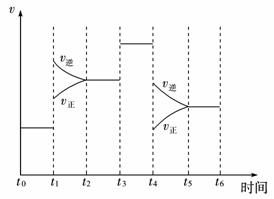
若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH____________0(填“大于”或“小于”)。
(3)合成氨工业中采用了较高压强(20~50 MPa),而没有采用100 MPa或者更大压强,试解释没有这么做的理由:____________ ____________ 。
(4)在容积均为2 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol N2、6 mol H2和1 mol N2、3 mol H2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中N2
转化率分别为α甲、α乙,则甲容器中平衡常数表达式为____________(用含α甲的代数式表示),此时α甲____________(填“>”“<”或“=”)α乙。
11.(2008年上海卷)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____________。已知:K300 ℃>K350 ℃,则该反应是____________热反应。

(2)右图中表示NO2的变化的曲线是____________。用O2表示从0~2 s内该反应的平衡速率v=____________。(3)能说明该反应已达到平衡状态的是____________。
a.v(NO2)=2v(O2)__________________ b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
10.一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):根据题意完成下列各题:

(1)反应达到平衡时,平衡常数表达式K=____________,升高温度,K值____________(填“增大”“减小”或“不变”)。
(2)500 ℃时,从反应开始到平衡,氢气的平均反应速率v(H2)=____________用
(nB、tB表示)
(3)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是____________。
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:-____________________________________(用化学方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com