
4.培养学习过程中探究、总结的习惯。
知识点一:水的电离
[例1](1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 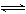 NH4++NH2-
NH4++NH2-
据此判断以下叙述中错误的是 ( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数
C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)
D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体----------------------------
②NaNH2溶于水的反应----------------------------------
③类似于“H++OH-=H2O”的反应----------------------------
解析:此题要求掌握水自偶的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生H+和NH2-,H+与NH3结合生成NH4+,液氨电离产生等量的NH2-与NH4+,一定温度下离子浓度乘积为一常数;NH4+类似于H+,NH2-类似于OH-。具备上述知识后,就可顺利完成解题。
答案:(1)C
(2)①2Na+2NH3=H2↑+2NaNH2
②NaNH2+H2O=NaOH+NH3↑或NH2-+H2O=OH-+NH3↑
③NH2-+NH4+ =2NH3↑或NH4Cl+NaNH2=2NH3↑+NaCl
练习:(1)纯硫酸、乙醇中也存在微弱的电离,写出其电离方程式
硫酸--------------------------------------------
乙醇---------------------------------------------
(2)乙醇钠中加水的反应--------------------------------------------
乙醇钠和NH4Cl的反应-----------------------------------
知识点二:水的离子积
[例2]某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
解析:由水电离产生的H+与OH-量始终相等,知纯水中C(H+) = C(OH-)。根据纯水中C(H+) 与C(OH-)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(OH-)。
答案:纯水中 C(OH-) = C(H+) = 2×10-7 mol/L
Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14
稀盐酸中 C(OH-) = Kw / C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L
[例3] .难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s) 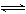 Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s)
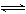 2Ag++CrO42-,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
2Ag++CrO42-,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
解析:(1)当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。几种离子共同沉淀某种离子时,根据各离子积计算出所需的离子浓度越小越容易沉淀。(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度可判断是否达到有效分离。
解答:(1)AgCl饱和所需 Ag+浓度[Ag+]1=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2= =4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=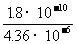 =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。
知识点三:水的电离平衡的移动
[例4] :某溶液中由水电离出来的C(OH-)=10-12mol/L,则该溶液中的溶质不可能是( )
A、HCl B、NaOH C、NH4Cl D、H2SO4
解析:由水电离反应式知:此溶液水电离产生的C(H+)=C(OH-) =10-12mol/L,若溶液中的H+全部来自水的电离,则此溶液显碱性,是因溶有碱类物质所致,若溶液中的H+不仅为水电离所产生,则此溶液显酸性,为酸性物质电离所致。NH4Cl不可能电离产生H+。
解答:C
下列两题为上题的变式,分析一下变在何处?解题方法、思路与上题是否一样?差异何在?
(1)室温下,在纯水中加入某物质后,测得溶液中由水电离产生的C(H+)=10-12mol/L,则加入的物质可能是(假设常温下碳酸、氢硫酸的第一步电离度为0.1%) ( )
A、通入CO2 B、通入H2S C、通入NH3 D、加入NaHSO4
(2)某溶液中水电离产生的C(H+)=10-3mol/L,,该溶液中溶质可能是( )
①Al2(SO4)3 ②NaOH ③NH4Cl ④NaHSO4
A、①② B、①③ C、②③ D、①④
[例5]能促进水的电离,并使溶液中C(H+)>C(OH-)的操作是 ( )
(1)将水加热煮沸 (2)向水中投入一小块金属钠 (3)向水中通CO2 (4)向水中通NH3 (5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体 (7)向水中加NaHSO4固体
A、(1)(3)(6)(7) B、(1)(3)(6) C、(5)(7) D、(5)
解析:本题主要考查外界条件对水的电离平衡的影响,请按如下思路完成本题的解:本题涉及到哪些条件对水的电离平衡的影响?各自对水的电离平衡如何影响?结果任何(C(H+)与C(OH-)相对大小)?归纳酸、碱、盐对水的电离平衡的影响。
解答: D
规律小结:
酸、碱:抑制水的电离
3.掌握混合溶液pH计算的方法,并能运用数学工具解决一些有关pH计算的综合问题
2.灵活解答水的电离平衡的相关问题;
1.通过对水的电离、离子积、pH定义等重要知识和方法迁移应用的练习,提高认知能力;
17.(20分) 总质量为80kg的跳伞运动员从离地500m的直升机上跳下,经过2s拉开绳索开启降落伞,如图所示是跳伞过程中的v-t图,试根据图像求:(g取10m/s2)
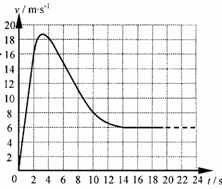 (1)t=1s时运动员的加速度和所受阻力的大小。
(1)t=1s时运动员的加速度和所受阻力的大小。
(2)估算14s内运动员下落的高度及克服阻力做的功。
(3)估算运动员从飞机上跳下到着地的总时间。
高三学生暑假作业,全部答案只能稍后给出。。。。。。。。。。
15(16分) 甲车以加速度3m/s2由静止开始作匀加速直线运动,乙车落后2s钟在同一地点由静止开始,以加速度4m/s2作匀加速直线运动,两车的运动方向相同,求:在乙车追上甲车之前,两车距离的最大值是多少?乙车出发后经多长时间可追上甲车?
16. (18分) 如图所示,物体A、B迭放在粗糙的水平地面上,物体A的质量为2kg,物体B的质量
为3kg,A与B间,B与地间的动摩擦因数均为0.5,绳的一端系住A,另一端系于墙上,绳与墙的
夹角为53°,取g=10m/s2,sin37°=0.6,cos37°=0.8。欲将B匀速地向右拉出,求:
(1)需加水平拉力F的大小,
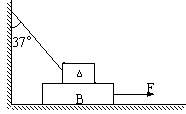 (2)此时A对B的摩擦力。
(2)此时A对B的摩擦力。
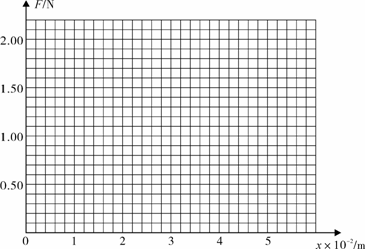
14. (1)某同学在竖直悬挂的弹簧下加挂钩码,做实验研究弹力与弹簧伸长量的关系。下表是他的实验数据。实验时弹力始终没有超过弹性限度,弹簧很轻,自身质量可以不计。
⑴根据实验数据在给定的坐标系中做出弹力F跟弹簧伸长量x关系的图像。
⑵根据图像可知弹簧的劲度系数为 N/m(保留两位有效数字)。
|
弹簧伸长量x/m |
弹力F/N |
|
0 |
0 |
|
0.012 |
0.30 |
|
0.023 |
0.60 |
|
0.035 |
0.90 |
|
0.046 |
1.20 |
|
0.058 |
1.50 |
13.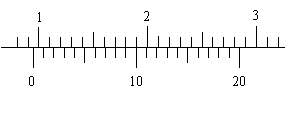 一游标卡尺的主尺最小分度为1mm,游标上有20个小等分间隔,现用此卡尺来测量一根金属圆管的外径时,卡尺上的游标位置分别如图所示,则这根圆管的外径读数是
mm。
一游标卡尺的主尺最小分度为1mm,游标上有20个小等分间隔,现用此卡尺来测量一根金属圆管的外径时,卡尺上的游标位置分别如图所示,则这根圆管的外径读数是
mm。
12.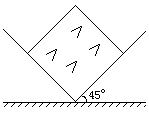 有一直角V形槽,固定放在水平面上,槽的两侧壁与水平面夹角均为45°,如图所示,有一质量为m的正方体均匀木块放在槽内,木块与槽两侧面间的动摩擦因数分别为
有一直角V形槽,固定放在水平面上,槽的两侧壁与水平面夹角均为45°,如图所示,有一质量为m的正方体均匀木块放在槽内,木块与槽两侧面间的动摩擦因数分别为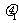 和
和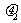 (
(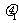 >
>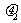 )。现用水平力推木块使之沿槽运动,则木块受到的摩擦力为
)。现用水平力推木块使之沿槽运动,则木块受到的摩擦力为
A.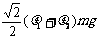 B.
B.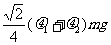
C.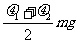 D.
D.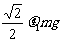
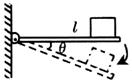
11. 如图(甲)所示,粗糙长木板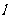 的一端固定在铰链上,木块放在木板上,开始木板处于水平位置。当木板向下转动,
的一端固定在铰链上,木块放在木板上,开始木板处于水平位置。当木板向下转动,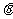 角逐渐增大的过程中,摩擦力Ff的大小随
角逐渐增大的过程中,摩擦力Ff的大小随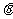 角变化最有可能的是图(乙)中的
角变化最有可能的是图(乙)中的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com