
5. 标准状况下有以下四种气体:①6.72L CH4 ②3.01×1023 HCl分子③13.6g H2S ④0.2mol NH3。下列对四种气体的关系从小到大表示不正确的是( )
A. 物质的量:④<①<②<③
B. 体积:④<①<③<②
C. 质量:④<①<③<②
D. 氢原子个数:②<④<③<①
答案:A
4. 设NA为阿伏加德罗常数,则下列说法不正确的是 ( )
A.标准状况下,22.4L水中含H原子个数大于2NA
B. 1mol 氦气中含有的分子个数为1NA
C.48g O2和48g O3含有的原子总数相等
D.在1L 1mol/L 的Mg(NO3)2溶液中含有NO3-的数目为1NA
答案:D
3. 0.2L 1 mol·L-1的FeCl3与0.1L 2 mol·L-1的KCl溶液中,Cl-物质的量之比为( )
A. 5:2 B. 1:1 C. 3:1 D. 1:3
答案:C
2. 下列叙述中,不符合科学性的是( )
A.同温同压下,任何气体的密度之比等于它们的摩尔质量之比
B.同温同压下,一种混合气体与一种纯净气体,若体积相同,则所含气体分子数也相同
C.同温同压下,同体积的任何气体的质量一定相同
D.同温同压下,任何气体的体积之比等于它们的物质的量之比
答案:C
1. 标准状况下,等质量的下列气体所占有的体积最大的是( )
A.O2 B.CH4 C.CO2 D.N2
答案:B
16.(09·上海卷 ·31T)烟气中
·31T)烟气中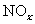 是NO和
是NO和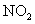 的混合物(不含
的混合物(不含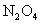 )。
)。
 (1)根据废气排放标准,
(1)根据废气排放标准,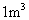 烟气最高允许含400mg
烟气最高允许含400mg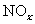 。若
。若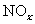 中NO质量分数为0.85,则
中NO质量分数为0.85,则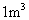 烟气中最高允许含NO__________L(标准状况,保留2位小数)。
烟气中最高允许含NO__________L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的
(2)工业上通常用溶质质量分数为0.150的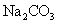 水溶液(密度1.16g/mL)作为
水溶液(密度1.16g/mL)作为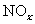 吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
 (3)已知:
(3)已知: 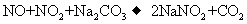 ①
①

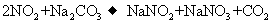 ②
②

 含2000mg
含2000mg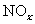 的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:
 NO+2HNO3→3NO2+H2O
NO+2HNO3→3NO2+H2O
 当烟气中
当烟气中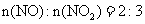 时,吸收率最高。
时,吸收率最高。

 烟气含2000mg
烟气含2000mg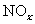 ,其中
,其中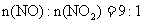 。
。
 计算:(i)为了达到最高吸收率,
计算:(i)为了达到最高吸收率,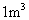 烟气需用硝酸的物质的量(保留3位小数)。
烟气需用硝酸的物质的量(保留3位小数)。
 (ii)
(ii)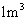 烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
答案 (1)0.25
(1)0.25
 (2)1.64
(2)1.64
 (3)不符合 因吸收后烟气总体积减小,
(3)不符合 因吸收后烟气总体积减小,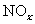 含量仍超过
含量仍超过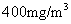
 (4)(i)
(4)(i)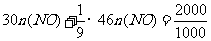
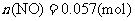



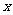
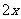
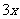

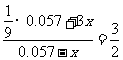
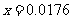
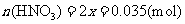
 (ii)
(ii)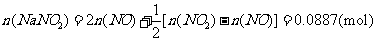

[考点精题精练]
1.5 mol,故选D。
15.( 06·全国Ⅱ·9T) 某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl-的物质的量约等于 ( )
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
答案 D
解析
因n(Mg2+)=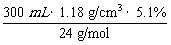 ≈0.75 mol,则n(Cl-)=2×0.75 mol=
≈0.75 mol,则n(Cl-)=2×0.75 mol=
14.(06·全国Ⅰ·13T)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4 mol·L-1,c(SO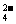 )=0.8
mol·L-1,则c(K+)为 ( )
)=0.8
mol·L-1,则c(K+)为 ( )
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
答案 C
解析
根据溶液中电荷守恒的原则,建立如下等式:c(H+)+c(K+)+3c(Al3+)=2c(SO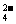 ),即0.1 mol/L+c(K+)+3×0.4 mol/L=2×0.8 mol/L,则c(K+)=0.3 mol/L,故答案为C。
),即0.1 mol/L+c(K+)+3×0.4 mol/L=2×0.8 mol/L,则c(K+)=0.3 mol/L,故答案为C。
13.(08·全国Ⅰ·13T)电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是 ( )
A.0.10 mol/L Ag+ B.0.20 mol/L Zn2+ C.0.20 mol/L Cu2+ D.0.20 mol/L Pb2+
答案 C
解析 100 mL溶液中各离子的物质的量分别为n(H+)=0.03 mol,n(Ag+)=0.01 mol,
n(Zn2+)=0.02 mol,n(Cu2+)=0.02 mol,n(Pb2+)=0.02 mol,当分别电解它们的溶液通过0.04 mol电子时,A中0.01 mol Ag全部析出,其质量为1.08 g,B中H+首先放电,因此析出Zn为0.005 mol,质量为0.325 g,C中0.02 mol Cu全部析出,质量为1.28 g,D中H+首先得电子,析出Pb为0.005 mol,质量为1.035 g,因此C中析出金属质量最大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com