
7.下列叙述错误的是
A.1mol任何物质都含有约6.02×1023个原子
B.0.012 kg 12C中含有约6.02×1023个碳原子
C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类
D.物质的量是国际单位制中七个基本物理量之一
6.下列说法正确的是
A、在任何条件下,1mol的任何气体的体积都是22.4 L。
B、把1mol NaCl溶于1 L水中,所得NaCl溶液的物质的量浓度为1mol/L。
C、在标准状况下,1mol的任何气体的体积都约为22.4 L。
D、在化学反应中,参加反应的各物质的质量比等于其物质的量之比。
5.下列溶液中含Cl-物质的量浓度最大的是
A.10mL0.1mol/L的AlCl3溶液 B.20mL0.1mol/L的CaCl2溶液
C.30mL0.2mol/L的KCl溶液 D.100mL0.25mol/L的NaCl溶液
4.下列分散系中的分散质的微粒直径属于纳米级(1~100nm)的是
A、溶液 B、悬浊液 C、胶体 D、 乳浊液
3.关于钠的说法正确的是
A、钠是银白色金属,硬度大
B、将钠放在石棉网上用酒精灯加热,钠剧烈燃烧产生黄色火焰,生成过氧化钠
C、钠在空气中燃烧生成氧化钠
D、钠的熔点很高
2.氯水用于消毒是因为
A、氯水中含有氯分子 B、氯水中含有次氯酸分子
C、氯水中含有氯离子 D、氯水中含有氢离子
1. 下列各组物质,前者是混合物,后者是纯净物的是( )
A、淀粉与氯化氢 B、钢与浓硫酸
C、纯碱与汽油 D、胆矾与液氯
31.(4分) 用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。
(1)计算需要______mL浓盐酸,
(2)在配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是______(填“偏高”、“偏低”、“无影响”)。
30.(10分)人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
[配制KMnO4标准溶液]下图是配制50mLKMnO4标准溶液的过程示意图。
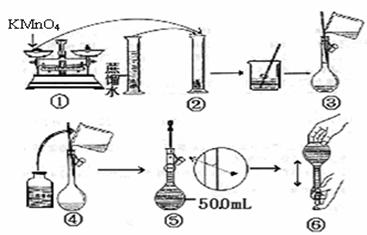
(1)请你观察图示判断其中不正确的操作有(填序号)____________;
(2)其中确定50mL溶液体积的容器是(填名称)__________________;
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将____________(填偏大或偏小)
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:2MnO4―+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O
则式中的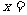 ________________。
________________。
(5)经过计算,血液样品中Ca2+离子的浓度为________mg/cm3。
29.(12分)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发生如下反应:Mn2++ S2O82-+ H2O→MnO4-+ SO42-+H+ 该反应常用于检验Mn2+的存在。
其特征现象是________ _ ,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)有关高锰酸钾参与的某个反应如下:KMnO4+KI+H2SO4 MnSO4+I2+KIO3+K2SO4+H2O
MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化剂是 。如果该反应方程式中I2和KIO3的化学计量数都是5,则H2O的化学计量数是 。
②如果没有对该方程式中的某些化学计量数作假定,可能的配平化学计量数有许多组,原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com