
某国科学考察队对东非大裂谷进行了为期5天的科学考察,此次考察队从埃塞俄比亚南部进入东非大裂谷,由北向南考察了东非大裂谷。本次科考旨在揭开“地球上最大疤痕”的秘密。据此回答3-4题。
3.位于东非大裂谷东西两侧的板块是:
A.亚欧板块 南美洲板块
B.印度洋板块 南极洲板块
C.非洲板块 印度洋板块
D.非洲板块 非洲板块
4.从形成原因上看,东非大裂谷的形成与科罗拉多大峡谷不同,其主要原因是( )
A.张裂作用 B.挤压作用
C.流水侵蚀作用 D.冰川侵蚀作用
读(07华师附中质检)读下图,完成1-2题
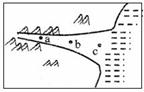
1.图中河流a、b、c三处主要的流水作用是( )
A.侵蚀、搬运、堆积B.搬运、侵蚀、堆积
C.侵蚀、堆积、搬运D.堆积、搬运、侵蚀
2.图中c处最有可能形成的河流地貌的名称
A.瀑布 B.洪积扇C.三角洲平原D.河漫滩平原
3、河流的堆积地貌

[典型例题]
例1、读某河道示意图,回答下列问题:
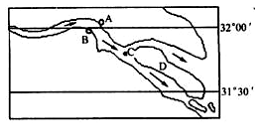
(1)某港务局拟在A、B两处河段建港,请问是选在A处还是B处好? ,理由是 。
(2)某勘探队在C处钻探获得粘土、砾石、粉砂、砂等沉积物标本,访问自上而下钻取的沉积物应依次是 ,其理由是 。
(3)小岛D因泥沙不断堆积而扩大,最终将与河流的哪岸相连? 。为什么? 。
(4)河流的下游常常造成什么堆积地形? 。其成因和特征如何? 。 例2、(09年海南地理第13,14,15题)读图4,完成(1)-(3)题。
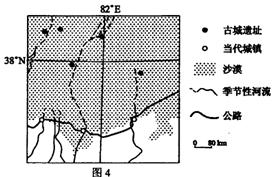
(1).制约图示区域城镇分布及城镇人口规模的主导因素是
A.交通线分布及线路等级 B.地表形态及土地面积C.热量条件及农作物产量 D.水资源分布及数量
(2).图示区域内,与古代相比,当代
A.河流水量更大 B.城镇向河流上游迁移
C.交通线离山地更远 D.山地森林覆盖率更低
(3).图示区域城镇面临的主要环境问题是
A.森林破坏 B.土地荒漠化
C.水土流失 D.地面沉降
[课堂检测]
2.河谷的发育过程
 (1)初期
(1)初期
当有稳定的地下水补给时,沟谷就变成河谷。
河谷与沟谷的区别: 是否有稳定的地下水补给。
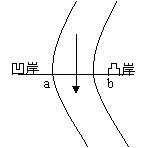
(2)中期: 河流在凹岸侵蚀,凸岸堆积,河谷出现连续的河湾。
下蚀作用减弱,侧蚀作用加强。如右图所示:
(3)成熟期:
河湾不断地向两侧扩展,最终将河谷展宽,并在河谷内堆积了大量泥沙。
(4). 河谷发育不同阶段的特征比较
|
形成阶段 |
河谷地貌 |
分布 |
主要侵蚀方式 |
|
初期 |
V字形 |
上游 |
溯源侵蚀,下蚀为主 |
|
中期 |
河湾 |
中游 |
下蚀减弱,侧蚀加强 |
|
成熟期 |
槽形河谷 |
下游 |
侧蚀为主 |
1.侵蚀的类型及对河流的影响
|
形 式 |
概 念 |
影 响 |
河 段 |
|
溯源侵蚀 |
向河流源头方向的侵蚀 |
使河谷不断向源头方向伸长 |
河源、上游 |
|
下 蚀 |
垂直于地面的侵蚀 |
使河床加深,河流向纵深方向发展 |
上中游 |
|
侧 蚀 |
垂直于两侧河岸的侵蚀 |
使谷底展宽,谷坡后退,河流向横向发展 |
中下游 |
3、山区的聚落主要分布在 、 和 上。由于洪积扇、冲积扇分布于 ,河漫滩平原沿 发育,所以,山区的聚落形成明显的 ,或分布于 ,或 发展。
[课内探究]
2、高原地区的聚落大多呈 分布在深切河谷两岸狭窄的 上。
1、在河流地貌中, 、 、 、 对河流流经地区的聚落分布均有明显的影响。
5、苯酚的用途:重要化工原料,制酚醛树脂、染料、药品,稀溶液可用于防腐剂和消毒剂。
试题枚举
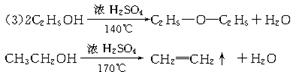
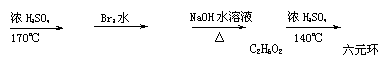 [例1]乙醇能发生下列所示变化:
[例1]乙醇能发生下列所示变化:
CH3CH2OH A C2H4Br2 B C
试写出A、B、C的结构简式。
 解析:根据所学知识得:CH3CH2OH在浓H2SO4作用下加热到170℃,发生消去反应生成CH2=CH2,CH2=CH2与溴水发生加成反应得到CH2BrCH2Br,CH2BrCH2Br与NaOH水溶液反应,两个溴原子被两个-OH取代,结构简式应为CH2-CH2,由B到C的反应条件可知发生的是分子间
解析:根据所学知识得:CH3CH2OH在浓H2SO4作用下加热到170℃,发生消去反应生成CH2=CH2,CH2=CH2与溴水发生加成反应得到CH2BrCH2Br,CH2BrCH2Br与NaOH水溶液反应,两个溴原子被两个-OH取代,结构简式应为CH2-CH2,由B到C的反应条件可知发生的是分子间
脱水反应,又因为C物质是环状结构,可推知C是由两分子B脱去两分子水形成的化合物,结构简式为 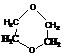
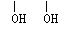 答案:A:CH2=CH2 B:CH2-CH2 C:
答案:A:CH2=CH2 B:CH2-CH2 C: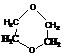
[例2]实验室常用溴化钠,浓硫酸与乙醇共热来制取溴乙烷,其反应的化学方程式如下:
NaBr+H2SO4 NaHSO4+HBr
NaHSO4+HBr
C2H5OH+HBr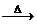 C2H5Br+H2O
C2H5Br+H2O
试回答下列各问:
(1)第二步反应实际上是一个可逆反应,在实验中可采取______和______的措施,以提高溴乙烷的产率.
(2)浓H2SO4在实验中的作用是________________,其用量(物质的量)应________于NaBr的用量(填大于、等于或小于).
(3)实验中可能发生的有机副反应(用化学方程式表示)是________和________.
解析:(1)乙醇与氢溴酸的反应是一个可逆反应:
C2H5OH+HBr C2H5Br+H2O
C2H5Br+H2O
在一定条件下会达到平衡状态.要提高溴乙烷的产率,就应设法使平衡正向移动.
(2)浓硫酸在第一个反应中是反应物,用难挥发的硫酸与NaBr反应制取氢溴酸.在第二个反应中浓H2SO4作为吸水剂,以减少反应体系中的水,使平衡正向移动,故投料时浓H2SO4物质的量应大于NaBr物质的量.
(3)浓H2SO4还具有脱水性,乙醇在浓H2SO4的作用下可发生分子内脱水生成乙烯,也可能发生分子间脱水生成乙醚.
答案:(1)增大某种反应物的量,如加过量NaBr以增加HBr的量 减小某种生成物的量,以使平衡正向移动,如加过量浓H2SO4吸水
(2)在第一个反应中是反应物,在第二个反应中是吸水剂 大于
[例3]乙醇的分子组成为C2H6O,现采用实验方法确定一个乙醇分子里有几个氢原子能被钠置换.测试装置如下图所示.
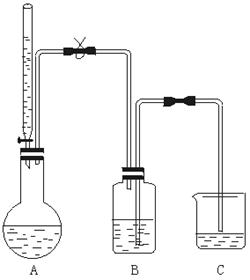
实验操作要点是:全部实验装置必须保证气密性良好;装置A要干燥,酸式滴定管中加入无水乙醇;过量金属钠先在二甲苯(二甲苯不跟金属钠反应)中分散成米粒大小的颗粒;连接B和C的玻璃导管内先要充满水而又不能发生虹吸;从滴定管中缓缓滴入无水乙醇V mL,同时松开弹簧夹,氢气将水由B压入C;待烧瓶恢复到常温后,测出C中所增加水的体积为V1 mL.(气体体积已折算成标准状况)
回答下列问题:
(1)如果实验开始前连接B和C的玻璃管内未充满水,则实验结果将__________.
(2)如果用普通酒精代替无水乙醇做实验,则所得实验结果将____________.
(3)连接A和B的导管的左段垂直部分要相当长,其作用是________________.
(4)把金属钠粉末分散成小颗粒的目的是__________________
(5)若无水乙醇的密度为r g/mL,则乙醇分子中被钠置换的氢原子个数为______.
解析:这是一道定量实验题,题目从误差分析,装置的作用、药品的处理和化学计算等多个角度提出问题,着重考查学生应用原有知识解决比较陌生的实际问题的能力,同时也能考查学生的思维严密程度.
要能正确回答题中各问,首先必须弄清实验目的和原理.实验的目的即是测定出一个乙醇分子里有几个氢原子能被钠置换.而实验原理是通过测定一定量的乙醇完全反应所产生氢气的体积来推算出一个乙醇分子里究竟有几个氢原子能被钠置换.
不难知道,产生H2的体积:V(H2)=(V1-V) mL
乙醇的物质的量:n(C2H6O)=Vρ/46 mol
所以每个乙醇分子中可被置换的氢原子数
N(H)=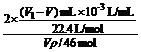 ,
,
即N(H)=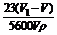
所以为使实验结果能精确,就必须精确测定V和V1,而不当操作则会引起误差.为使讨论方便,我们将上式等效转化成下式:
N(H)=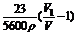
其中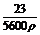 为常数,且不论操作正确与否,数据处理时乙醇的体积数V仍取测定值,故V也为一常数,因此误差分析时可以将不当操作都归结到对V1的影响,如果V1偏大,则结果偏高,反之亦然.
为常数,且不论操作正确与否,数据处理时乙醇的体积数V仍取测定值,故V也为一常数,因此误差分析时可以将不当操作都归结到对V1的影响,如果V1偏大,则结果偏高,反之亦然.
如果实验开始前连接B和C的玻璃管内未充满水,则会使V1减小,故实验结果偏小;如果用普通酒精代替无水乙醇,则会引起V1增大,故实验结果偏大.
从以上的误差分析可以总结出一条规律,即进行误差分析前首先必须建立一个数学模型(即测量对象与所求对象的数学关系式),然后在此基础上进行误差判断.
至于连接A和B的导管的左段垂直部分要相当长,原因是可以依靠外界冷空气使其冷凝回流,防止其逸散,有利于乙醇完全反应.而把金属钠粉散成小颗粒,也是鉴于此目的.
答案:(1)偏小 (2)偏大
(3)使乙醇蒸气冷凝回流
(4)使之反应完全
(5)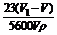
4、化学性质
⑴弱酸性: 俗名石炭酸,加入石蕊不变色
① 酸性的验证:浊液中加入NaOH变澄清
②酸性强弱及验证:
a. 酸性 :
b. 弱酸性:
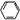
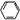 思考: -OH+Na2CO3 → -ONa+NaHCO3 ?
思考: -OH+Na2CO3 → -ONa+NaHCO3 ?
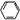
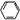 -OH+NaHCO3 → -ONa+CO2+H2O ?
-OH+NaHCO3 → -ONa+CO2+H2O ?
⑵取代反应:(易与Br2、HNO3发生苯环H取代,不能发生-OH取代)
①卤代(反应方程式):
注意:a常温下浓溴水即能与苯酚反应,说明苯酚的取代比苯及同系物容易,
b此反应常用于苯酚的定性检验、与定量测定,
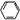 c ( -OH)的除杂与分离:
c ( -OH)的除杂与分离:
②硝化: 2,4,6-三硝基苯酚,俗名:苦味酸,烈性炸药
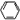 ⑶显色反应:苯酚+Fe3+→溶液呈紫色(用于Fe3+和 -OH的相互鉴别(方程式)
⑶显色反应:苯酚+Fe3+→溶液呈紫色(用于Fe3+和 -OH的相互鉴别(方程式)
⑷其它反应:氧化反应、缩聚反应、酯化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com