
2、 硫酸根离子的检验(干扰离子可能有:CO32-、SO32-、SiO32-、Ag+、PO43-等离子):
待测液 澄清液
澄清液 白色沉淀(说明待测液中含有SO42-离子)
白色沉淀(说明待测液中含有SO42-离子)
[针对性训练]
甲、乙、丙三学生各设计了一个实验,结果各自都认为自己所检测的试样中含有SO42-离子。
(1)甲实验为:
试样A的无色溶液 白色沉淀
白色沉淀 沉淀不溶解。
沉淀不溶解。
乙认为甲的实验不严谨,因为试样A中若含有 离子(仅填一种),也会有此现象。
(2)乙实验为:
试样B的无色溶液 白色沉淀
白色沉淀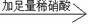 沉淀不溶解。
沉淀不溶解。
丙认为乙的实验也不严谨,因为试样B中若含有 离子(仅填一种),也会有此现象。
(3)丙实验为:
试样C的无色溶液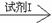 现象I
现象I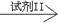 现象II。
现象II。
若丙方案实验后公认为合理,则回答:试剂I是 ,实验中必须加至 ,此时的现象I是 ;试剂II是 ,此时的现象II是 。
1、硫酸的用途:制过磷酸钙、硫酸铵、硫酸铜、硫酸亚铁、医药、炸药,用于铅蓄电池,作干燥剂、制挥发性酸、作脱水剂和催化剂等。
3、用含FeS278%的硫铁矿制硫酸,若煅烧时,损失6%的硫,二氧化硫氧化成三氧化硫时损失2%的硫。要制取1t98%的浓硫酸,需这种硫铁矿 t。
3、环境污染和环境保护:
(1)环境污染:_________ _________ _________ ___________等。
(2)工业“三废”:___________ ____________ ______________。
[针对性训练]
1、接触法制硫酸时,二氧化硫在接触室中钒触媒的作用下,被空气中的氧气氧化而发生反应:2SO2(g)+ O2(g)  2SO3(g);
2SO3(g);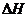 =-1965kJ/mol,接触室的适宜温度为
。其理由是
。
=-1965kJ/mol,接触室的适宜温度为
。其理由是
。
工业上并未采用加压的措施来提高二氧化硫的产率,其理由是
。
2、在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A、硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B、从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C、二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D、三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全
2、尾气处理: 氨水 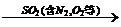 (NH4)2SO3
(NH4)2SO3 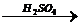 (NH4)2SO4+
SO2↑
(NH4)2SO4+
SO2↑
NH4HSO3
1、生产过程:
|
三阶段 |
SO2制取和净化 |
SO2转化为SO3 |
SO3吸收和H2SO4的生成 |
|
三方程 |
|
|
|
|
三设备 |
|
|
|
|
有 关 原 理 |
矿石粉碎,以增大__ __________________________________ |
逆流原理(热交换器中:管___ ___气体__,管_____气体__)目的:冷气预热至_____℃以上,热气冷却至____℃以下. |
逆流原理(浓硫酸____,气体____)增大接触面积(吸收塔内入填料)以充分吸收。 |
|
设备中排出的气 体 |
炉气:SO2.N2.O2.矿尘(除尘).砷硒化合物(洗涤). H2O气(干燥)…… 净化气:SO2.N2.O2 |
|
尾气:
不能直接排入大气中 |
|
说 明 |
矿尘.杂质:易使催化剂“中毒” H2O气:腐蚀设备、影响生产 |
接触室内压强为____压。 为什么?__________ |
实际用___________吸 收SO3,以免形成___ |
2、化学性质:
(1)强氧化性(常温下,浓硫酸可使________等金属________)
Cu+H2SO4(浓) ─ (可体现浓硫酸的 性和 性)
C+H2SO4 (浓) ─
H2S+H2SO4(浓) ─
FeS+H2SO4(浓) ─
[针对性训练]
1、足量的锌和下列酸反应,产生H2的物质的量最多的是( )
A、10mL 18.4mol/L 硫酸 B、30mL 3mol/L盐酸
C、30mL 2mol/L 硫酸 D、30mL 5mol/L硝酸
2、(1)向50mL 18mol/L 的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量( )
A、等于0.9mol B、大于0.45mol,小于0.9mol
C、等于0.45mol D、小于0.45mol
(2)若将64g铜片投入到足量的浓硫酸中,则被还原的硫酸的物质的量为 。
(2)吸水性:吸收物质中的水蒸气或结晶水。可用作干燥剂,但一般不能干燥 性和_____性气体。(浓硫酸可用作有机反应的催化剂和吸水剂)
(3)脱水性:将某些化合物中氢、氧按2:1原子个数比脱去。(浓硫酸可用作有机反应的催化剂和脱水剂)
注:浓硫酸在有机反应中还可起磺化作用,如苯与浓硫酸反应。
[针对性训练]
1、现有O2、NH3、H2、H2S、Cl2、N2、HI、HBr、CO、CO2、SO2、SO3等气体,其中
不可用浓硫酸干燥的有 。
2、浓硫酸使石蕊试纸先变 色,后变 色。
3、皮肤上一旦沾有浓硫酸,应先 ,再 ,最后再涂上 溶液。
1、 物理性质: 色油状 挥发(沸点338℃)液体,密度大(质量分数为98%的浓硫酸密度为1.84g/cm3),且质量分数越大其对应的密度也越大,易溶于水,溶于水时放出大量的热.。稀释浓硫酸应把______沿______注入_______中,并___________以防_______________。
[针对性训练]
1、浓硫酸与乙醇、浓硝酸等液体如何混合?
2、质量分数为3p%的X溶液与p%的X溶液等体积混合后,混合液的质量分数小于
2p%。则X可能是下列物质中的( )
A、氨水 B、硫酸溶液 C、乙醇溶液 D、氢氧化钠溶液
5、跟盐反应:Na2CO3+ H2SO4-
BaCl2 + H2SO4-
[针对性训练]
1、现有四份等质量等浓度的稀硫酸,向其中分别加入足量的Mg、MgO、Mg(OH)2、MgCO3,充分反应后所得溶液的质量分数大小关系为 。
2、铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去,试写出除去铜绿而不损伤器物的反应的化学方程式: 。
4、 跟碱反应:NaOH+H2SO4-
Cu(OH)2+H2SO4-
Ba(OH)2+H2SO4-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com