
2、物质的量相等的HBr和H2SO3
溶液中,中通入0.1mol Cl2 ,结果有 的Br-被氧化,求HBr的物质的量?
的Br-被氧化,求HBr的物质的量?
有机物化合价升降的计算
(1)得氧或失氢被氧化,每得1个O原子或失去2个H原子,化合价升高2。
(2)失氧或得氢被还原,每失去1个O原子或得2个H原子,化合价降低2。
例:CH3CH20H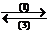 CH3CHO
CH3CHO  CH3COOH
CH3COOH
过程(1)是失氢,氧化过程,化合价升高1×2
过程(2)是得氧,氧化过程,化合价升高2×1
过程(3)是加氢,还原过程,化合价升高1×24
练习3
1、在100mLFeBr2 中通入Cl2 2.24L(STP),充分反应后,有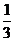 的Br-被氧化,则原FeBr2 的浓度是多少mol·L-1 (分别用电子得失相等和电解质溶液电荷守恒来解题)
的Br-被氧化,则原FeBr2 的浓度是多少mol·L-1 (分别用电子得失相等和电解质溶液电荷守恒来解题)
5、有关计算
在氧化还原反应中,氧化剂与还原剂得失电子数相等。这是进行氧化还原反应计算的基本依据。
举例:
3、氧化还原反应的基本规律
(1)表现性质规律
当元素具有可变化合价时,一般处于最高价态时只具有氧化性,处于最低价态时只具有原性,处于中间价态时既具有氧化性又具有还原姓。如:浓H2SO4的S只具有氧化性,H2S中的S只具有还原性,单质S既具有氧化性又具有还原性。
(2)性质强弱规律
在氧化还原反应中,强氧化剂+强还原剂=弱氧化剂(氧化产物)+弱还原剂(还原产物),即氧化剂的氧化性比氧化产物强,还原剂的还原性比还原产物强。如由反应2FeCl3+2KI=2FeC3+2KCl+I2可知, FeCl3的氧化性比I2强,KI的还原性比FeCl2强。
一般来说,含有同种元素不同价态的物质,价态越高氧化性越强(氯的含氧酸除外),价态越低还原性越强。如氧化性:浓H2SO4,S02(H2S03),S;还原性: H2S>S>SO2。
在金属活动性顺序表中,从左到右单质的还原性逐渐减弱,阳离子(铁指Fe2+)的氧化性逐渐增强。
(3)反应先后规律
同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与含多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质。如:将Cl2通人物质的量浓度相同的NaBr和NaI的混合液中,C12首先与NaI反应;将过量铁粉加入到物质的量浓度相同的Fe2+、和Cu2+的混合溶液中,Fe首先与Fe3+反应。FeBr2 中通入Cl2 ,HBr和H2SO3 中通入Cl2
(4)价态归中规律
含不同价态同种元素的物质问发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价一中间价”,而不会出现交错现象。

KClO3+6HCl =KCl+3Cl2+3H2O 而不是KClO3+2HCl=KCl+3Cl2+3H2O
(5)歧化反应规律
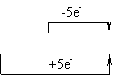
发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:
Cl2十2NaOH=NaCl十NaClO十H20
2、物质氧化性和还原性相对强弱的判断方法
(1)根据金属活动顺序进行判断


[说明]一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。如Cu2++2e→Cu远比Na+ +e→Na容易,即氧化性Cu2+>Na+,还原性Na> Cu
(2)根据非金属活动顺序进行判断
(3)根据氧化还原反应的发生规律判断
氧化还原反应发生规律可用如下式子表示:

氧化性:反应物中的强氧化剂,生成物中的弱氧化剂
还原性:反应物中的强还原剂,生成物中的弱述原剂
例:已知①2FeCl3+2KI=2FeCl2+I2+2KCl
②2FeCl2+C12=2FeCl3
由①知,氧化性Fe3+>I2,由②知,氧化性C12>Fe3+,综合①②结论,可知氧化性Cl2>Fe3+
(4)根据氧化还原反应发生反应条件的不同进行判断
如:Mn02十4HCl(浓)?MnCl2+C12↑+2H20
2KMn04十16HCl(浓)=2MnCl2+5C12↑+8H2O
后者比前者容易(不需要加热),可判断氧化性 KMn04>Mn02
(5)根据被氧化或被还原的程度的不同进行判断
Cu十C12?CuCl2
2Cu+S ? Cu2S
C12可把Cu氧化到Cu(+2价),而S只能把Cu氧化到 Cu(+1价),这说明氧化性Cl2>S
(6)根据元素周期表判断
①对同一周期金属而言,从左到右其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
②对同主族的金属和非金属可按上述方法分析。
1、氧化还原反应的重要概念
练习1:判断下列那些为氧化还原反应,并说出理由
IBr + H2O = HBr + HIO
KOH+Cl2=KCl +KClO+H2O
NaH+H2O =NaOH+H2
CaO2+H2O =Ca(OH)2 +H2O2
5C2H5OH +2KMnO4+3H2SO4 →5CH3CHO +K2SO4+2MnSO4 +8H2O
氧化还原反应的实质是 ,
判断氧化还原反应的依据是 。
小结:氧化还原反应发生规律和有关概念可用如下式子表示:

练习:练习1中是氧化还原反应的,请指出氧化剂,还原剂,氧化产物,还原产物,标出电子转移的方向和数目。
17.已知定点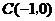 及椭圆
及椭圆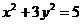 ,过点
,过点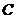 的动直线与椭圆相交于
的动直线与椭圆相交于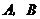 两点.
两点.
(Ⅰ)若线段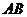 中点的横坐标是
中点的横坐标是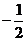 ,求直线
,求直线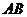 的方程;
的方程;
(Ⅱ)在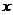 轴上是否存在点
轴上是否存在点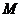 ,使
,使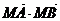 为常数?若存在,求出点
为常数?若存在,求出点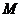 的坐标;若不存在,请说明理由.
的坐标;若不存在,请说明理由.
解:(Ⅰ)依题意,直线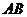 的斜率存在,设直线
的斜率存在,设直线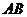 的方程为
的方程为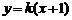 ,
,
将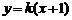 代入
代入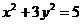 ,
消去
,
消去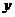 整理得
整理得

设 则
则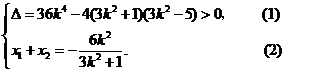
由线段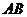 中点的横坐标是
中点的横坐标是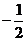 , 得
, 得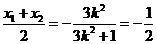 ,
,
解得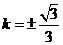 ,适合
,适合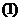 .
.
所以直线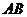 的方程为
的方程为
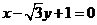 ,或
,或
 .
.
(Ⅱ)假设在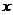 轴上存在点
轴上存在点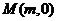 ,使
,使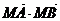 为常数.
为常数.
① 当直线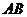 与
与 轴不垂直时,由(Ⅰ)知
轴不垂直时,由(Ⅰ)知 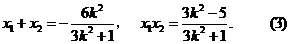
所以

将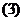 代入,整理得
代入,整理得

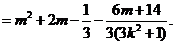
注意到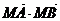 是与
是与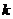 无关的常数,
从而有
无关的常数,
从而有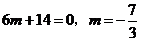 ,
此时
,
此时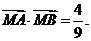
② 当直线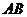 与
与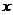 轴垂直时,此时点
轴垂直时,此时点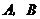 的坐标分别为
的坐标分别为 ,
,
当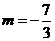 时,
亦有
时,
亦有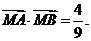
综上,在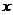 轴上存在定点
轴上存在定点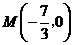 ,使
,使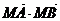 为常数.
为常数.
16.(2009福建卷文)(本小题满分14分)
已知直线 经过椭圆
经过椭圆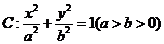
的左顶点A和上顶点D,椭圆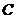 的右顶点为
的右顶点为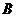 ,点
,点 和椭
和椭
圆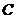 上位于
上位于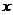 轴上方的动点,直线,
轴上方的动点,直线,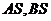 与直线
与直线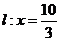
分别交于 两点。
两点。
(I)求椭圆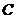 的方程;
的方程;
(Ⅱ)求线段MN的长度的最小值;
(Ⅲ)当线段MN的长度最小时,在椭圆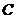 上是否存在这
上是否存在这
样的点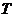 ,使得
,使得 的面积为
的面积为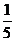 ?若存在,确定点
?若存在,确定点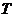 的个数,若不存在,说明理由
的个数,若不存在,说明理由
解法一:
(I)由已知得,椭圆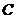 的左顶点为
的左顶点为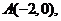 上顶点为
上顶点为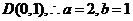
故椭圆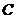 的方程为
的方程为
(Ⅱ)直线AS的斜率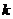 显然存在,且
显然存在,且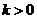 ,故可设直线
,故可设直线 的方程为
的方程为 ,从而
,从而
由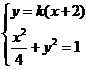 得
得 0
0
设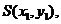 则
则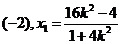 得
得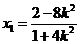 ,从而
,从而
即 又
又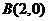
由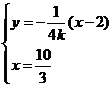 得
得
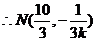
故
又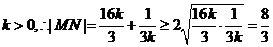
当且仅当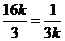 ,即
,即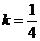 时等号成立
时等号成立
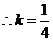 时,线段
时,线段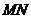 的长度取最小值
的长度取最小值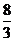
(Ⅲ)由(Ⅱ)可知,当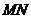 取最小值时,
取最小值时,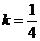
此时 的方程为
的方程为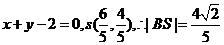
要使椭圆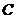 上存在点
上存在点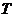 ,使得
,使得 的面积等于
的面积等于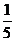 ,只须
,只须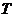 到直线
到直线 的距离等于
的距离等于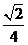 ,所以
,所以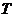 在平行于
在平行于 且与
且与 距离等于
距离等于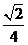 的直线
的直线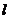 上。
上。
设直线
则由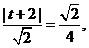 解得
解得 或
或
15.如图,已知椭圆 的焦点是
的焦点是 、
、 ,过
,过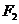 作互相垂直的两条直线
作互相垂直的两条直线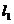 、
、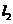 ,
,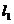 交椭圆
交椭圆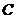 于
于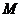 、
、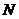 两点,
两点,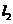 交椭圆
交椭圆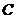 于
于 、
、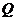 两点,且
两点,且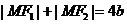
(Ⅰ)求椭圆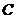 的方程;
的方程;
 (Ⅱ)求证
(Ⅱ)求证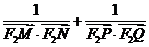 为定值.
为定值.
解: (Ⅰ)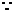
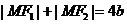
 由椭圆的定义知
由椭圆的定义知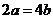 即
即
又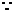
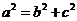 ,
,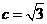

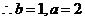
所以椭圆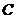 的方程为
的方程为
(Ⅱ)解法一:由题知直线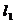 、
、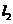 中至少有一条斜率存在,不妨设直线
中至少有一条斜率存在,不妨设直线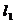 的斜率为
的斜率为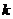 ,则直线
,则直线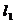 的方程为
的方程为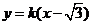
(1)当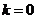 时,
时,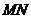 与椭圆长轴重合,
与椭圆长轴重合,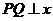 轴
轴

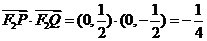


(2)当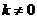 时,
时,
由 得
得 
设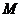 、
、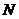 的坐标分别为
的坐标分别为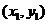 、
、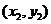
则 ,
,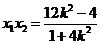 ,
,



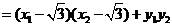
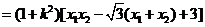
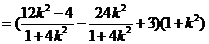
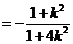
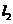 斜率为
斜率为 ,同理可得
,同理可得

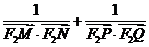
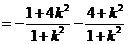
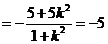
综合(1)(2)知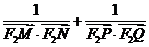 为定值
为定值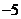
14.(2009辽宁卷理)(本小题满分12分)
已知,椭圆C过点A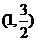 ,两个焦点为(-1,0),(1,0)。
,两个焦点为(-1,0),(1,0)。
(1) 求椭圆C的方程;
(2) E,F是椭圆C上的两个动点,如果直线AE的斜率与AF的斜率互为相反数,证明直线EF的斜率为定值,并求出这个定值。
解:
(Ⅰ)由题意,c=1,可设椭圆方程为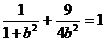 ,解得
,解得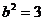 ,
, (舍去)
(舍去)
所以椭圆方程为 。
……………4分
。
……………4分
(Ⅱ)设直线AE方程为: ,代入
,代入 得
得
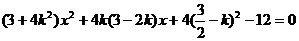
设 ,
,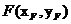 ,因为点
,因为点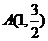 在椭圆上,所以
在椭圆上,所以
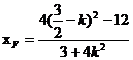
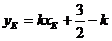 ………8分
………8分
又直线AF的斜率与AE的斜率互为相反数,在上式中以-K代K,可得


所以直线EF的斜率
即直线EF的斜率为定值,其值为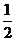 。
……12分
。
……12分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com