
5. 如图所示,将质量为m的滑块放在倾角为θ的固定斜面上。滑块与斜面之间的动摩擦因数为μ。若滑块与斜面之间的最大静摩擦力与滑动摩擦力大小相等,重力加速度为g,则:
A.将滑块由静止释放,如果μ>tanθ,滑块将下滑
 B.给滑块沿斜面向下的初速度,如果μ<tanθ,滑块将减速下滑
B.给滑块沿斜面向下的初速度,如果μ<tanθ,滑块将减速下滑
C.用平行于斜面向上的力拉滑块向上匀速滑动,如果μ=tanθ,拉力大小应是2mgsinθ
D.用平行于斜面向下的力拉滑块向下匀速滑动,如果μ=tanθ,拉力大小应是mgsinθ
4.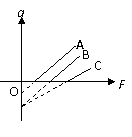 物体A、B、C均静止在同一水平面上,它们的质量分别为mA、mB、mC,与水平面的动摩擦因数分别为μA、μB、μC,用平行于水平面的拉力F分别拉物体A、B、C,所得加速度a与拉力F的关系如图所示,A、B两直线平行,则以下关系正确的是:
物体A、B、C均静止在同一水平面上,它们的质量分别为mA、mB、mC,与水平面的动摩擦因数分别为μA、μB、μC,用平行于水平面的拉力F分别拉物体A、B、C,所得加速度a与拉力F的关系如图所示,A、B两直线平行,则以下关系正确的是:
A.mA<mB<mC B.mA<mB=mC
C.μA=μB=μC D.μA<μB=μC
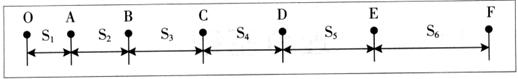
3. “研究匀变速直线运动”的实验中,使用电磁式打点计时器(所用交流电的频率为50Hz),得到如图所示的纸带。图中的点为计数点,相邻两计数点间还有四个点未画出来,下列表述正确的是:
A.实验时应先放开纸带再接通电源
B.(S6一S1)等于(S2一S1)的6倍
C.从纸带可求出计数点B对应的速率
D.相邻两个计数点间的时间间隔为0.02s
2.一个物体在多个力的作用下处于静止状态。如果仅使其中的一个力大小逐渐减小到零,然后又从零逐渐恢复到原来的大小(此力的方向始终未变),在这过程中其余各力均不变.那么,下列各图中能正确描述该过程中物体速度变化情况的是:


1.伽利略为了研究自由落体的规律,将落体实验转化为著名的“斜面实验”,从而创造了一种科学研究的方法。利用斜面实验主要是考虑到:
A.实验时便于测量小球运动的速度和路程
B.实验时便于测量小球运动的时间
C.实验时便于测量小球运动的路程
D.斜面实验可以通过观察与计算直接得到落体的运动规律

20. 联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)===N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
19. 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
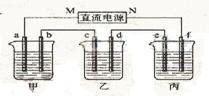
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
 ①电源的N端为______极;
①电源的N端为______极;
②电极b上发生的电极反应为_______________________;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是_________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________;
乙溶液______________________________;
丙溶液______________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
____________________________________。
18.
某二元酸(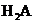 )在水中的电离方程式是:
)在水中的电离方程式是: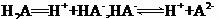 回答下列问题:
回答下列问题:
(1)判断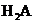 是强电解质还是弱电解质? ,理由是
。
是强电解质还是弱电解质? ,理由是
。
(2)已知 溶液中氢离子的物质的量浓度应
溶液中氢离子的物质的量浓度应
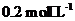 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
。
(3)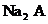 溶液显
(填“酸性”、“中性”或“碱性”)。理由是(用离子方程式表示) 。NaHA液溶中离子浓度的大小顺序是:
。
溶液显
(填“酸性”、“中性”或“碱性”)。理由是(用离子方程式表示) 。NaHA液溶中离子浓度的大小顺序是:
。
(4)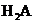 溶液和
溶液和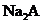 溶液能否发生反应? ,能反应的写出离子方程式
(如不能反应此问不答)
溶液能否发生反应? ,能反应的写出离子方程式
(如不能反应此问不答)
17. (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(2)向pH=6的蒸馏水和c(H+)=10-6mol·L-1的稀盐酸中分别投入大小、质量相同的金属钠,反应刚开始时,产生H2的速率前者与后者相比是 (填选项序号)。
A、一样快 B、前者快 C、后者快 D、无法比较
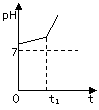 (3)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
(3)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
① 在0→t时间内,两个电极上的电极反应式为:
阳极 ;阴极 。
②用离子方程式表明0→t时间内,溶液pH升高比较缓慢的原因: 。
16.氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化作用下由F2和过量NH3反应得到。
NF3属于 晶体,写出制备 NF3的化学反应方程式: 。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子、离子有: 、 (各举1例),由此可推知N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:Co[(N3)(NH3)5]SO4、
(Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。
Co[(N3)(NH3)5]SO4中钴的配位数为 ,CN-中C原子的杂化类型是 。
 (3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是 (填“极性”、“非极性”)分子。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是 (填“极性”、“非极性”)分子。
 (4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是
(选填序号)
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是
(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如右图,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com