
1、判断元素金属性强弱。
a、单质跟水或酸反应置换氢的氢的难易,易则强。
b、最高价氧化物的水化物的碱性强弱,碱性强则强。
c、置换反应,强换弱。
3、启发人们在一定区域内寻找新物质。
2、 按周期表的位置寻找元素 启发人们在一定区域内寻找新物质(农药、半导体、催化剂等)。
1、预测元素的性质(由递变规律推测)
常见的题目给出一种不常见的主族元素(如砹、碲、铋、铅、铟、镭、铯等),或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。解答的关键是根据该元素所在族的熟悉的元素的性质,根据递变规律,加以推测判断。
3.元素周期表的应用
|
项 目 |
同周期(从左到右) |
同主族(从上到下) |
|
价电子数 (最外层电子数) |
由1逐渐增到7 |
相同 |
|
主要化合价 |
最高正价由 +1→+7 负价由 -4→-1 |
最高正价相同 |
|
原子半径 |
逐渐减小(惰性气体除外) |
逐渐增大 |
|
金属性与非金属性 |
金属性减弱 非金属性增强 |
金属性增强 非金属性减弱 |
|
最高价氧化物对应水化物的酸碱性 |
碱性减弱 酸性增强 |
碱性增强 酸性减弱 |
|
非金属的气态氢 化物 |
生成由难到易 稳定性由弱到强 |
生成由易到难 稳定性由强到弱 |
|
得失电子能力 |
失电子由 大→小 得电子由 小→大 |
得电子由 大→小 失电子由 小→大 |
原子序数=核电荷数=核内质子数=核外电子数
周期序数=电子层数
主族序数=最外层电子数=元素的最高正价数
*|最高正价数|+|负价数|=8
元素周期表结构的记忆方法如下:
横行叫周期,共有七周期;三四分长短,第七不完全;一八依次现,一零再一遍;
竖行称作族,总共十六族;Ⅷ族最特殊,三行是一族;二三分主副,先主后副;镧锕各十五,均属ⅢB族;构位性一体,相互可推断。
 3个短周期 (1、2、3周期)
3个短周期 (1、2、3周期)
 周期(7个) 3个长周期 (4、5、6周期)
周期(7个) 3个长周期 (4、5、6周期)
1个不完全周期(7周期)
 元素周期表
主族(7个) IA~VIIA
元素周期表
主族(7个) IA~VIIA
副族(7个) IB~VIIB
族(16个) VIII族(1个) 8、9、10三个纵行
零族 (1个) 最右边一个纵行(惰性气体元素)
归纳:七主、七副、一八、一零;三长、三短、一不完全。
6、若正方体的棱长为 ,则以该正方体各个面的中心为顶点的凸多面体的体积为
,则以该正方体各个面的中心为顶点的凸多面体的体积为
(A)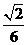 (B)
(B)  (C)
(C)
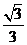 (D)
(D) 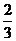
5、与正方体各面都相切的球,它的表面积与正方体的表面积之比为__ _
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com