
3.(2010年广东深圳调研)下面各句中加点的词语,使用恰当的一项是( )
A.不久前,中国银监会主席刘明康公开呼吁干涉市场。刘明康是中国金融业监管层第一个表态呼吁“救市”的高官,因此吹响了政府“救市”的“集结号”。
B.最令人错愕和震惊的是,和正常的反映相反,西方政府和民间社会组织竭力迎合“藏独”分子的行为。
C.漫长的许霆案已经落下帷幕,但是对许霆案的社会意义窥一斑而知全豹:有人借此看见人性中德性的薄弱,有人欢呼公众舆论的强大,还有人试图用它来警醒法律的疲惫。
D.当下,整个神州大地正在掀起一股公祭大潮,炎帝、黄帝、大禹、孔子、老子……纷纷被抬出来供顶礼膜拜。老祖宗们不再是躺在博物馆里睡大觉的老古董,而是成了人们争相抢夺的香饽饽。
解析:选D。A项,“因此”改为“由此”。B项,“反映”应为“反应”,“反应”指事情发生后在人们中间引起的意见或行动。C项,窥一斑而知全豹:指从局部而推知全体,从个别而推知一般。应为“莫衷一是”。D项,香饽饽:比喻受欢迎的人或事物。
2.(2010年吉林市普通高中模拟)将下列词语依次填入下面这段话的横线处,最恰当的一组是 ( )
奥巴马在竞选中曾________他的总体外交和安全政策思路,认为通过外交手段与伊朗领导人________接触,比______加强制裁更有利于伊朗核问题的________。
A.阐述 直接 单纯 解决
B.阐述 直截 纯粹 处理
C.阐发 直截 单纯 处理
D.阐发 直接 纯粹 解决
解析:选A。阐述。论述;阐发:阐述并发挥。直接:不经过中间事物;直截:言语、行动等简单爽快。单纯:单一,不复杂。纯粹:表示不掺杂别的成份。解决:处理问题使有结果;处理。安排,解决,不一定有结果。
1. (2010年江苏淮安模拟)依次填入下列各句横线上的词语,最恰当的一组是( )
(1)为了庆祝中华人民共和国建国五十八周年,他特地精心铸造了62式中华人民共和国升旗指挥刀________给国旗护卫队。
(2)贫困线下的儿童与奢侈消费的明星,被捐赠者与捐赠者,两方面境况的悬殊一度使明星慈善行为倍受________。
(3)在西方,虽然无车日不再是媒体关注的热点,但欧洲各国通过减少私车行驶来改善环境的努力并未________。
A.惠赠 质疑 终止 B.惠赠 置疑 中止
C.敬赠 置疑 中止 D.敬赠 质疑 终止
解析:选D。惠赠:敬辞,指对方赠予(财物);敬赠:恭敬地赠送。质疑:提出疑问;置疑:怀疑(多用于否定式)。终止:结束,停止;中止:(做事)中途停止。
2.微粒半径大小比较中的规律
(1)同周期元素的原子或最高价阳离子半径从左至右渐小(稀有气体元素除外)
如:Na>Mg>Al>Si;Na+>Mg2+>Al3+。
(2)同主族元素的原子或离子半径从上到下渐大
如:Li<Na<K,O<S<Se,Li<Na+<K+,F-<C1-<Br-。
(3)电子层结构相同(核外电子排布相同)的离子半径(包括阴、阳离子)随核电荷数的增加而减小。
如Na+、Mg2+、Al3+、F-、02-的离子半径大小排列为02->F->Na+>Mg2+>Al3+,(上一周期元素形成的阴离子与下一周期元素形成的阳离子有此规律)。
可归纳为:电子层排布相同的离子,(表中位置)阴离子在阳离子前一周期,(大小)序数大的半径小。
(4)核电荷数相同(即同种元素)形成的微粒半径大小为
阳离子<中性原子<阴离子,价态越高的微粒半径越小,如Fe3+<Fe2+,H+<H<H-,C1<C1-
(5)电子数和核电荷数都不同的,一般可通过一种参照物进行比较。
如:比较Al3+与S2-的半径大小,可找出与Al3+电子数相同,与S2-同一族元素的O2-比较,Al3+<02-,且O2-<S2-,故A13+<S2-。
(1)两性氧化物:既能与酸起反应生成盐和水,又能与碱起反应生成盐和水的氧化物。例:A1203
A1203+6HCl=2AlCl3+3H20
A1203+2NaOH=2NaAl02+H20
(2)两性氢氧化物:既能跟酸起反应,又能跟碱起反应的氢氧化物。例:Al(OH)3,
2Al(OH)3+3H2S04=Al2(S04)3+6H20
A1(OH)3+NaOH=NaAl02+2H20
(1)最外层电子数=最高正化合价
(2)|最低负化合价|+最高正化合价=8
例2、元素R的最高价含氧酸的化学式为HnRO2n-2,则在气态氢化物中R元素的化合价为多少?
解析:由HnRO2n-2知R的最高价为+(3n-4),R在气态氢化物中为负价:-[8-(3n-4)]=-12+3n。
以第三周期为例说明
|
原子序数 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|||
|
元素符号 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar ar |
|||
|
原子的最外电子层数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|||
|
原子半径 |
大 小 逐渐增大 小 逐渐增大 |
||||||||||
|
主要正价 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
0 |
|||
|
主要负价 |
|
|
|
-4 |
-3 |
-2 |
-1 |
0 |
|||
|
最高价氧化物对应的水化物 |
NaOH 强碱 |
Mg(OH)2 中强碱 |
Al(OH)3 两性 |
H4SiO4 弱酸 |
H3PO4 中强酸 |
H2SO4 强酸 |
HClO4 最强酸 |
|
|||
|
金属单质与水反应的情况 |
剧烈 反应 |
缓慢 反应 |
难以 反应 |
|
|
|
|
|
|||
|
非金属单质与H2反应的条件 |
|
|
|
高温 |
较高 温度 |
需加热 |
光照或点燃 |
|
|||
|
结论 |
 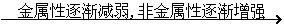 |
||||||||||
随原子序数的递增、元素原子的最外层电子排布呈周期性变化。[核外电子层数相同的原子,随原子序数的递增、最外层电子数由1递增到8]。
随原子序数的递增,元素的原子半径发生周期性的变化。[核外电子层数相同的原子,
随原子序数的递增、原子半径递减(稀有气体突增)]。
元素的化合价随着原子序数的递增而起着周期性变化。
[主要化合价:正价+1→+7;负价-4→-1,稀有气体为零价]。
元素周期律
元素的性质随着原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
说明:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
周期性变化不是机械重复,而是在不同层次上的重复。稀有气体原子半径突然变大是同稀有气体原子半径测量方法与其它原子半径的测量方法不同。O、F没有正化合价是因为它们非金属性强。
例题 下列各组元素中,按原子半径依次增大顺序排列的是:
A、Na、 Mg、 Al B、Cl、 S、 P C、Be、N、 F D、Cl、 Br、 I
解析:Na、Mg、Al核外电子层数相同,核电荷数依次增大,原子半径依次减小,所以A错误则B正确,Be、N、F无规律比较,最外层电子数相同时随核外电子层数的增大、原子半径依次增大,所以D正确。
答案:B、D。
7.向量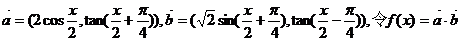 .
.
是否存在实数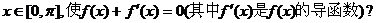 若存在,则求出x的值;若不存在,则证明之.
若存在,则求出x的值;若不存在,则证明之.
解: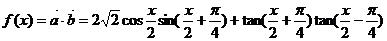
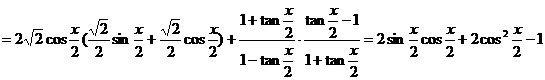
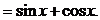
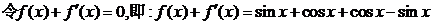

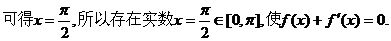
6.在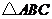 中,已知内角
中,已知内角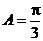 ,边
,边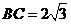 .设内角
.设内角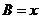 ,周长为
,周长为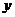 .
.
(1)求函数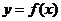 的解析式和定义域;(2)求
的解析式和定义域;(2)求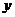 的最大值.
的最大值.
解:(1)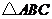 的内角和
的内角和 ,由
,由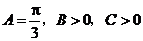 得
得 .
.
由正弦定理知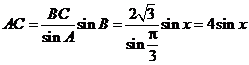 ,
,
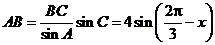 .
.
因为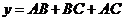 , 所以
, 所以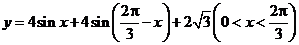 ,
,
(2)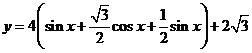
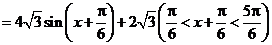 ,
,
所以,当 ,即
,即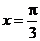 时,
时,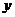 取得最大值
取得最大值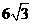 .
.
5.已知函数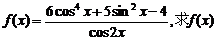 的定义域,判断它的奇偶性,并求其值域.
的定义域,判断它的奇偶性,并求其值域.
解:由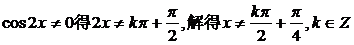 .
.
所以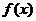 的定义域为
的定义域为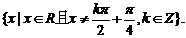
因为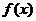 的定义域关于原点对称,且
的定义域关于原点对称,且
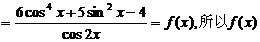 是偶函数.
是偶函数.
当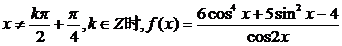
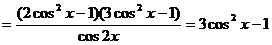 ,
,
所以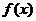 的值域为
的值域为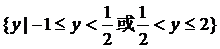
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com