
2.分解法:如2KClO3 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4 C+2H2 2H2O2
C+2H2 2H2O2 2H2O+O2↑
2H2O+O2↑
1.电解法
①电解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF2 F2↑+H2↑+2KF
F2↑+H2↑+2KF
3.比较非金属性强弱的八条依据
(1)元素在周期表中的相对位置
①同周期元素,自左向右,元素的非金属性依次增强,如F>O>N>C>B;Cl>S>P>S i等。
②同主族元素自上而下,非金属性依次减弱,如F>Cl>Br>I;O>S>Se;N>P>As等 。
(2)非金属单质与氢气化合的越容易,非金属性越强。如F2、Cl2、Br2、I2 与H2化合由易到难,所以,非金属性F>Cl>Br>I。
(3)气态氢化物的越稳定,非金属性越强,如稳定性HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金属性F>O>Cl>N>Br>I>S>P。
(4)最高价氧化物对应的水化物的酸性越强,非金属性越强,如酸性HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,则非金属性Cl>S>P>C>Si。
(5)非金属性强的元素的单质能置换出非金属性弱的元素的单质。如2F2+2H2O=4HF+O2↑;O2+4HCl=2H2O+2Cl2(地康法制Cl2);Cl2+2NaBr=2NaCl+Br2 ;3Cl2+2NH3=N2+6HCl;Cl2+H2S=S+2HCl。
(6)非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。
(7)与变价金属反应时,金属所呈价态越高,非金属性越强,如Cu+Cl2 CuCl2;2Cu+S
CuCl2;2Cu+S Cu2S,说明非金属性Cl>S。
Cu2S,说明非金属性Cl>S。
(8)几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱,如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
2.元素的非金属性与非金属单质活泼性是并不完全一致的:如元素的非金属性O>Cl, N>Br;而单质的活泼性:O2 <Cl2,N2<Br2。但由于某些非金属单质是双原子分子,原子间以强烈的共价键相结合(如N N等),
当参加化学反应时,必须消耗很大的能量才能形成原子,表现出了单质的稳定性。这种现象不一定说明这种元素的非金属性弱。强的分子内共价键恰是非金属性强的一种表现。
1.常见非金属元素的非金属性由强到弱的顺序: F、O、Cl、N、Br、I、S、P、C、Si 、H
3.非金属单质的聚集状态和同素异形体:
①典型的非金属单质在固态时为分子晶体,如:F2、Cl2、Br2、I2、O2、S、N2、P4、H2,这些晶体表现为硬度不大,熔点不高,易挥发、不导电,它们在常温下聚集态为气态(“气”字头)液态(“氵”旁)或固态(“石”字旁)
②碳(金刚石)、硅、硼为原子晶体,硬度很大,熔沸点很高。由于原子晶体中没有离子和自由电子,所以固态和熔融态都不导电。但某些原子晶体,如单晶硅可以作为半导体材料。
③非金属元素常出现同素异形现象。如:金刚石与石墨;白磷与红磷;O2与O3;S2、S4、S8等互为同分异构体。
2。原子结构特点及化合价:
Ⅰ.最外层电子均大于、等于3(除H以外),与其主族序数相同。
Ⅱ.最高正价分别为:+4 +5 +6 +7(与族序数相等)
对应最低负价:-4 -3 -2 -1(等于族序数减8)
Ⅲ.非金属元素一般都有变价:除呈现上述最高价及最低价以外,有的非金属还呈现其它价态。如:
S:+4价;N:+1 +2 +3 +4价; Cl:+1 +3 +5价。
1.位置:在已知的元素中,非金属共22种(包括6种稀有气体元素),除氢元素位于周期表的ⅠA族外,其余都集中在元素周期表阶梯线(硼、硅、砷、碲、砹斜线)的右上方。
26.正常情况下,人体内环境的成分和理化性质能够维持相对稳定,这是机体进行正常生命活动的必要条件。
(1)血浆是内环境的主要组成部分,血浆渗透压的大小主要与血浆中的___________含量有关。
(2)正常人的血浆近中性,pH值为7.35-7.45,血浆的pH之所以能够保持稳定,与它含有 等离子有关。空腹血糖浓度为0.8-1.2g/L,当人体血糖浓度略有下降,此时体内____ _____(激素)分泌增加,该激素作用的靶细胞主要是____ __。
(3)目前普遍认为, 调节网络是机体维持稳态的主要调节机制,其中免疫系统是通过它的 等功能,实现它在维持稳态中的作用。
(4)体温的恒定对于人体正常生命活动至关重要。剧烈运动时骨骼肌产热增加,同时机体会通过____________、________________两条主要途径加强散热,以维持体温恒定。
[答案](9分)
(1)无机盐、蛋白质(全对才给分)
(2)HCO3-、HPO32- 胰高血糖素 肝细胞
(3)神经-体液-免疫 防卫、监控和清除(答2个得1分,答3个得2分)
(4)汗腺分泌增加 皮肤血管舒张
25.下列图中A、B为人体内两种不同组织处的毛细
血管,①②③示某些化学物质。请据图回答:
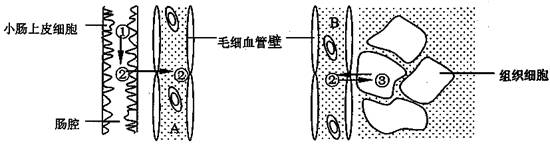
(1)毛细血管的管壁细胞生活的内环境是 。
(2)如果①为淀粉,则②进入A的方式是 ,②从小肠上皮细胞吸收到被组织细胞利用至少穿过了 层磷脂分子;若该组织细胞为肝细胞,当正常人体处于饥饿状态时,A中②的浓度比B中的要 ,这是因为
;在肝细胞中②物质与③物质的转化是可逆的,如果②物质能转化为③物质,而③物质不能转化为②物质,则图中的细胞最可能是
细胞。
(3)如果①为蛋白质,则②最多有 种,②由A运输到B,再由B进入组织细胞内,②在组织细胞中可以被用来合成 。
(4)如果①为脂肪,则小肠上皮细胞吸收②时细胞内的ADP含量会升高吗? ;理由是 。碳源、能源依次是 、 。
[答案](10分)(1)血浆 组织液(写全给分)
(2)主动运输 14 低 饥饿时肝糖元分解为葡萄糖并释放到血液中 肌肉
(3)20 各种组织蛋白质、酶、某些激素(写出一个即可)
(4)不会 小肠吸收 ②是自由扩散,不消耗能量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com