
4、覆盖保护膜(涂油漆,电镀,钝化等)。
1、牺牲阳极的阴极保护法
⑴、原理:形成原电池反应时,让被保护金属做 极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
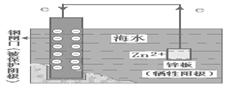 ⑵、装置图:
⑵、装置图:
[科学探究]:验证牺牲阳极的阴极保护法
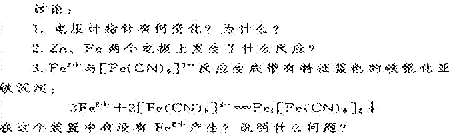
[板 书]:2、外加电流阴极保护法:
⑴、原理:将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为 极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。
 ⑵、装置图:
⑵、装置图:
|
[过 渡]:除此以外还有哪些防护方法?
[归纳小结]:3、改变金属的内部结构(钢→不锈钢,在钢中加入镍和铬)。
3、化学腐蚀与电化学腐蚀的比较:
|
|
电化腐蚀 |
化学腐蚀 |
|
条件 |
不纯金属或合金与
接触 |
与
直接接触 |
|
有无电流 |
有微弱电流产生 |
无电流产生 |
|
本质 |
较活泼的金属被氧化 |
金属被氧化 |
|
联系 |
两种腐蚀往往 发生,但 腐蚀更普遍,速度快,危害更重。 |
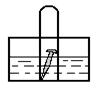 [典型例题]:例1、如图, 水槽中试管内有一枚铁钉,放置数天观察:
[典型例题]:例1、如图, 水槽中试管内有一枚铁钉,放置数天观察:
⑴、若液面上升,则溶液呈 性,
发生 腐蚀,电极反应式为:负极:
正极:
⑵、若液面下降,则溶液呈 性,发生 腐蚀,
电极反应式为:负极: 正极:
例2、钢铁在锈蚀过程中,下列5种变化可能发生的是 ( C. )
①、Fe由+2价转化为+3价 ②、O2被还原 ③、产生H2
②、④、Fe(OH)3失水形成Fe2O3·H2O ⑤、杂质碳被氧化除去
A. ①② B. ③④ C. ①②③④ D. ①②③④⑤
[过 渡]:请大家根据铁生锈的原因,我们可以采取哪些措施防止铁生锈?
[板 书]:二、金属的电化学防护
1、定义:不纯的金属跟电解质溶液接触时。会发生 反应
的金属失去电子而被 。如 在潮湿的空气中生锈。
[过 渡]: 钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或湿度较大的环境里长期放置,常易生锈变红,是什么原因?下面我们就来讨论钢铁在潮湿的空气中生锈的原因?
[实验探究]:P85将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入下图具支试管中,观察导管中水柱变化,并思考引起变化的原因?吸氧腐蚀

[板 书]:2、类型:
⑴ 、吸氧腐蚀:中性或酸性很弱或碱性条件下,易发生 腐蚀。
负极:2Fe - 4e- = 2Fe2+ 正极:O2 + 2H2O + 4e-= 4OH-
电池反应:2Fe+ O2 +2 H2O =2Fe(OH)2
进一步反应:4Fe(OH)2 +O2 + 2H2O = 4 Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O
 ⑵、析氢腐蚀:当钢铁处于酸性环境中
⑵、析氢腐蚀:当钢铁处于酸性环境中
负极:Fe - 2e- = Fe2+
正极:2H+ + 2e- =H2↑
电池反应:Fe + 2H+ =Fe2+ + H2↑
⑶、析氢腐蚀和吸氧腐蚀比较
|
|
析氢腐蚀 |
吸氧腐蚀 |
|
|
条
件 |
水膜呈 |
水膜呈 |
|
|
电极 反应 |
负极(Fe极) |
|
|
|
正极(C极) |
|
|
|
|
总反应 |
|
|
|
|
联系 |
|
2、影响因素:与接触物质的氧化性有关和温度越高,化学腐蚀越 。
1、定义: 金属与接触到的干燥气体(如 、 、 等)或非电解质液体(如 )等直接发生化学反应而引起的腐蚀。如:钢管被原油中的 腐蚀,
3、类型:化学腐蚀--直接反应 电化学腐蚀--原电池反应
2、本质:M – ne- → Mn+(氧化反应)
1、定义:是指金属或合金跟接触的气体或液体发生氧化还原反应而腐蚀损耗的过程。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com