
7、近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的 ( C )
A 铝质轻,便于运输、贮存,且安全
B 铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制
C 在地球上,铝矿资源丰富
D 现代电解冶铝的工业技术已为铝作为新能源奠定了重要基础
6、最近,科学家冶炼出纯度高达99.999 %的铁,你估计它具有性质是 ( AB )
A.硬度比生铁小 B.在冷、浓H2SO4中可以钝化
C.在潮湿的空气中放置比生铁易生锈
D.当它与生铁的粉碎粒度相同时,与4mol/L盐酸反应速率比生铁大
5、白铁皮(镀锌)发生析氢腐蚀时,若有0.2mol电子发生转移,下列说法正确的是(AD )
A. 有6.5g锌被腐蚀 B. 在标准状况下有22.4L氢气放出
C. 有2.8g铁被腐蚀 D. 在标准状况下有2.24L气体放出
4、以下现象与电化学腐蚀无关的是 ( D )
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿 B. 生铁比软铁芯(纯铁)容易生锈
C. 铁制器件附有铜制配件,在接触处易生铁锈 D. 银制奖牌久置后表面变暗
3、X、Y、Z、M代表四种金属,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为 ( A )
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
2、下列事实不能用电化学原理解释的是 ( A )
A.常温条件下,在空气中铝不容易被腐蚀 B.镀锌铁片比镀锡铁片更耐腐蚀
C.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 D.远洋海轮的尾部装上一定数量的锌板
1.下列叙述中正确的是 (B )
①锌跟稀硫酸制取氢气,加入少量硫酸铜溶液能加快反应速率 ②镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 ③钢铁表面常易锈蚀生成 Fe2O3 · H2O
A. 都正确 B. ①③ C. ① D. ②③
2、埋在地下的铸铁输油管道,在下列各种情况下被腐蚀的速度最慢的是( C )
A. 在含铁元素较多的酸性土壤中 B. 在潮湿疏松透气的土壤中
C. 在干燥致密不透气的土壤中 D. 含碳粒较多、潮湿透气的中性土壤中
江苏省五汛中学高二选修化学课课练(33) 教师版
课题:金属的电化学腐蚀与防护 主备人:王洋先 日期:2009-04-29
2、在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>防腐措施的腐蚀
[变式训练]:1、下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是(4)(2)(1)(3)
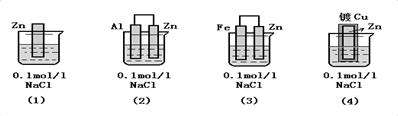
5、金属被保护的效果比较:
电解池的阴极保护得最好 > 原电池的正极 > 一般保护
[典型例题]:例3、为了防止钢铁锈蚀,下列防护方法中正确的是 ( CD )
A. 在精密机床的铁床上安装铜螺钉
B. 在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C. 在海轮舷上用铁丝系住锌板浸在海水里
D. 在地下输油的铸铁管上接直流电源的负极
例4、下列事实不能用电化学理论解释的是 ( B )
A.轮船水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保存
C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D.镀锌的铁比镀锡的铁耐用
[解 析]:A选项是通过构成Zn-Fe原电池,在船壳上加Zn块构成原电池负极,从而保护船体不被腐蚀。B选项是靠氧化膜保护铝。C选项Zn+Cu2+====Cu+Zn2+,生成的Cu与Zn在溶液中构成原电池加快反应的速率。D选项中Zn-Fe原电池Zn为负极,而Fe-Sn原电池中Fe为负极,故前者Zn被氧化保护了铁。答案:B
[问题探究]:探究一:镀锌铁皮和镀锡铁皮哪个更易被腐蚀?为什么?
探究二:纯锌和粗锌哪个更易和酸反应?如向酸中再加硫酸铜又会什么现象?
[板 书]:三、影响金属腐蚀快慢比较
[典型例题]:例5、下列各情况,在其中Fe片腐蚀由快到慢的顺序是 52134
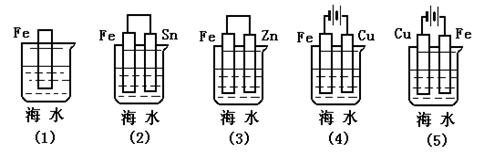
[结 论]:1、原电池正极、电解池阴极受到保护
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com