
16、分别用波长为λ和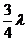 的单色光照射同一金属板,发出的光电子的最大初动能之比为1:2,以h表示普朗克常量,c表示真空中的光速,则此金属板的逸出功为:
的单色光照射同一金属板,发出的光电子的最大初动能之比为1:2,以h表示普朗克常量,c表示真空中的光速,则此金属板的逸出功为:
A.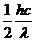 B.
B.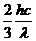 C.
C.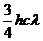 D.
D.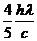
15、关于近代物理学的结论中,下面叙述中正确的是:
A.宏观物体的物质波波长非常小,极易观察到它的波动性
B.光电效应现象中,光电子的最大初动能与照射光的 频率成正比
频率成正比
C.光的干涉现象中,干涉亮条纹部分是光子到达几率大的地方
D.氢原子的能级是不连续的,但辐射光子的能量却是连续的
14、下面是四种与光有关的事实 ,其中与光的干涉有关的是
:
,其中与光的干涉有关的是
:
A.用光导纤维传播信号
B.用透明的标准样板和单色光检查平面的平整度
C.一束白光通过三棱镜形成彩色光带
D.水面上的油膜呈现彩色
30.(8分)苹果酸是一种浓缩饮料的主要酸性物质。分离提纯后的化学分析如下:
(1)元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24∶3∶40;该酸蒸气的密度是同温同压下氢气密度的67倍。
(2)0.l mol该酸与足量NaHCO3反应放出4.48 L CO2,与足量金属Na反应放出3.36 L H2(气体体积均已折算为标准状况下的体积)。
(3)该酸分子结构中没有支链。
29.(12分)某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
① 准确称量m g样品(2~3g);
② 向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③ 量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④ 趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤ 过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A、比mg多 B、比mg少 C、恰好为mg
(2)溶解样品时要加入盐酸,原因是 。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器 是 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl ②Fe2(SO4)3
28.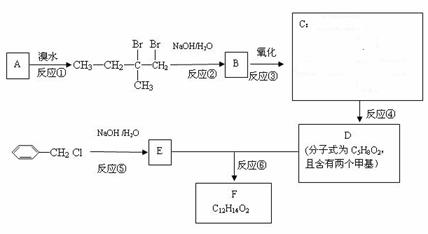 (14分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
(14分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
|
试回答下列问题:
|
(2)C物质的官能团名称______;E物质的结构简式___________;
(3)上述合成路线中属于取代反应的是 (填编号);
(4)反应④的化学方程式为 ;
(5)写出E属于芳香族化合物同分异构体(不含E)的结构简式:
27.(8 分)下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,L是水,D是淡黄色固体,E为单质。
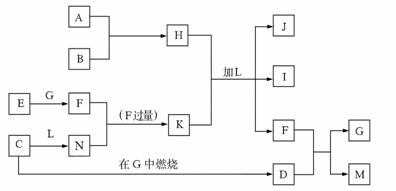
试填写下列空白:
(1)写出F的化学式: _______________。
(2)写出M发生水解的化学反应方程式__________________。 (3)反应C+G→D的化学方程式是_______________。 (4)写出H 、K加L生成J、I、F反应的离子方程式_______________。
26.(8分)下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
-- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
-- |
|
最低价态 |
-- |
-- |
-2 |
-- |
-4 |
-3 |
-1 |
-- |
-3 |
-1 |
(1)以上10种元素的原子中,最容易失电子的是 (填写元素符号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 、 (写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
 (3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多
多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色
的物质(其中“●”表示元素②的原子),右图为该物质部分原子分
布示意图,请根据图找出原子排列规律并写出该物质的化学式
。
25.在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为 ( )
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
第II卷(非选择题,共50分)
24.某有机物与过量的金属钠反应,得到VA升气体,另一份等质量的该有机物与小苏打反应得到气体VB升(同温、同压),若VA>VB(VB≠0),则该有机物可能是 ( )
A.HOCH2CH2OH B.CH3COOH
C.HOOC-COOH D.HOOC-C6H4-OH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com