
4. (09年全国卷文综Ⅱ第3题)近期研制出利用玉米叶片加工、编织购物袋的技术,这种购物袋易分解且物美价廉,该种购物袋的生产原料在我国的最大产地是 ( )
A.河南省 B.吉林省 C.四川省 D.吉林省
答案 D
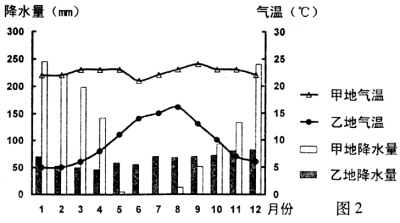
(09年重庆文综第5题)读图2,回答下题。
(09年海南地理第19,20题)1979-2000年,我国蔬菜种植规模和种植地区分布都发生了显著变化。分析表1、表2,完成2-3题。
表1 我国蔬菜种植面积、总产量
|
年份 |
种植面积(万h㎡) |
总产量(万t) |
|
1979 |
18.0 |
896.0 |
|
1980 |
360.6 |
16335.2 |
|
1999 |
1335.0 |
40513.5 |
|
2000 |
1523.7 |
42399.7 |
表2 我国商品蔬菜种植面积的分布
|
区域 |
1980年 |
1999年 |
|
大城市郊区 |
70% |
20% |
|
其他农区 |
30% |
80% |
2.1979--2000年我国蔬菜 ( )
A.植面积2000年比前一年增加最多
B.面积产量经历了高-低一高的变化
C.位面积产量下降
D.郊区蔬菜种植面积减少
答案 C
3.从1980--1999年商品蔬菜种植面积分布的变化,可以推断出 ( )
A.沿交通干线出现一批蔬菜种植基地 B.农村地区蔬菜的商品率降低
C.粮食种植面积大幅度缩小 D.通过大规模垦荒,增加了耕地面积
答案 A
2009高考题
1. (09年广东地理第11题)有人把自然资源丰富国家经济发展水平低于自然资源匮乏国家的现象称为“资源诅咒”。对于这种现象,下列解释最合理的是 ( )
A.自然资源质量差 B.资源开发成本过高
C.经济发展过分依赖资源输出 D.资源收入主要用于社会福利
答案 C
4. 与苯的反应:
☆三大强酸的对比
|
|
硝酸 |
硫酸 |
盐酸 |
|
重要物理性质 |
纯净硝酸为无色液体,常见浓硝酸因溶有分解产生的NO2 而呈黄色,易挥发。能以任意比与水混溶 |
无色油状液体,难挥发。能以任意比与水混溶 |
纯净盐酸为无色液体,常见盐酸含有工业杂质(Fe3+)而呈黄色 |
|
重要化学性质 |
强酸性;不稳定性,受热见光易分解;浓稀硝酸均有强氧化性 |
强酸性;稀硫酸只表现酸性,浓硫酸既表现酸性又表现吸水性、脱水性、强氧化性 |
强酸性;还原性(浓度越大还原性越强) |
|
实验室制法 |
硝酸钠与浓硫酸微热 |
|
氯化钠与浓硫酸强热 |
|
工业制法 |
NH3
~NO~NO2 ~HNO3 注:NO循环氧化吸收 |
FeS2~2SO2
~2SO3 ~2H2SO4 注:SO2 循环氧化吸收 |
H2 在Cl2 中燃烧生成的HCl 用水吸收 |
☆关于浓酸变稀的问题
从上表中可看出三大强酸有一个共同的特点--浓度不同时所表现的性质有所不同,记住此点会给我们解题带来重要突破。记住下列反应:
4HNO3(浓) + Cu = Cu(NO3)2 + 2NO2 ↑+ 2H2O
8HNO3(稀) + 3Cu = 3Cu(NO3)2 + 2NO↑+ 4H2O
2H2SO4(浓)+ Zn = ZnSO4 + SO2 ↑+2H2O
H2SO4(稀) + Zn = ZnSO4 + H2 ↑
 4HCl (浓 + MnO2
MnCl2 +Cl2
↑+2H2O
4HCl (浓 + MnO2
MnCl2 +Cl2
↑+2H2O
试题枚举
[例1]Murad等三位教授提出NO在人体内有独特的功能,关于NO的叙述正确的是
①NO可以是某些含低价氮物质氧化的产物
②NO不是亚硝酸酐
③NO可以是某些含高价氮物质还原的产物
④NO是无色气体
A.全部 B.①③④
C.②③④ D.①④
解析:NO中氮的化合价处于中间价态,它可以是还原产物,如HNO3→NO,也可以是氧化产物,如NH3→NO;HNO2的酸酐是N2O3;NO是无色气体。所以,所给的几种说法都正确。
答案: A
[例2]“摇摇冰”是一种即用冷的饮料,吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会致冷。该化学物质是
A NaCl B NH4NO3(s) C NaOH(s) D CaO(s)
解析:溶解过程中伴随着能量的变化,固体硝酸铵溶于水吸热,使温度降低,固体氢氧化钠溶于水放热,使溶液温度升高,生石灰与水的反应也放出大量的热,氯化钠溶解过程中能量的变化很小。
答案:B
[例3]同温同压下,在3支相同体积的试管中分别充有等体积的2种气体,它们是(1)NO和NO2(2)NO2和O2(3)NH3和N2。现将3支试管均倒置于水槽中,充分反应后剩余气体的体积分别是V1、V2、V3,则下列关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V3>V1>V2
解析:设每种气体的体积为1体积,则:(1)中剩余1+(1/3)=4/3体积气体;(2)中剩余3/4体积的氧气;(3)中剩余1体积的N2.
答案:B
在进行氮氧化物计算时,要注意有关循环氧化、由多步反应合并所得总反应的应用。记注下列反应:
4NO2 + O2 + 2H2O = 4HNO3 4NO +3O2 + 2H2O = 4HNO3
NO2 + NO + 2NaOH = 2NaNO2 + H2O 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
[变式]在一定温度和压强下,将装有N2和NO2混合气体的试管倒立于水中,足够时间后,试管内气体体积缩小为原来体积的3/5,则远混合气体中N2和NO2的体积比
A.2:3 B.3:2 C.3:5 D.5:3
答案:A
3. C与浓硝酸的反应:
2. 铜与浓硝酸的反应:
浓、稀硝酸均为强氧化性酸,与金属反应均不产生氢气,但浓硝酸的氧化性更强,浓硝酸一般被还原成NO2,稀硝酸一般被还原成NO;浓硝酸具有挥发性、不稳定性,遇金属铁、铝产生钝化现象;因此保存时要把它盛放在棕色瓶里,储存在阴暗而且温度低的地方。
练习:写出下列化学方程式:
1. 硝酸的不稳定性:
2. 化学性质:(1)受热分解:NH4Cl
NH4HCO3
铵盐的受热分解比较复杂,并非都生成对应的酸和氨气。
(2)与碱的反应:
思考:NH4+的检验:操作为
离子方程式为
1. 物理性质:都是离子晶体,都易溶于水。
1.结构: (电子式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com