
4、下列离子,在水溶液中不发生水解的是 ( )
A.Ag+ B.I- C.F- D.Cu2+
3、在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3+的水解,当溶液中c(Fe3+)= c(SO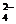 )
)
时,下列判断正确的是 ( )
A.c(Fe3+)>c(Cl-)
B.c(SO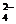 )>c(Cl-)
)>c(Cl-)
C.c(SO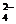 )<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
)<c(Cl-)
D.FeCl3和Fe2(SO4)3的物质的量相等
2、在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓
度分别为Amol·L-1与Bmol·L-1,则A和B的关系为 ( )
A.A>B B.A=10-4B C.B=10-4A D.A=B
1、在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
( )
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
20.1mol/L H2S溶液中电荷守恒___________________物料守恒_________________
[巩固练习]
(1)电荷守恒:电解质溶液中无论含多少种离子,但溶液总是呈电中性的。即整个溶液中________所带的负电荷总数一定等于_____所带正电荷总数。如在NH4Cl溶液中有_____________________
(2)原子守恒(物料守恒):电解质溶液中尽管有些离子水解、电离等原因发生改变,但某原子总数是保持不变的。如NH4Cl中存在____________________.
针对性练习:写出下列溶液中的各种守恒关系:
10.1mol/LNa2CO3溶液中:电荷守恒:____________ 物料守恒:________________.
1判断溶液的酸碱性:
(1) 将.1mol/L的下列溶液按PH由小到大的顺序排列1Na2CO32NaHCO3 3NaOH 4NaNO3 5CH3COOH 6NaHSO4 7NH4Cl_______________________
(2) 酸式盐溶液的酸碱性:酸性NaHSO3 NaH2PO4 碱性NaHCO3 NaHS Na2HPO4
2判断溶液中离子浓度的大小:
(1) CH3COONa溶液中离子浓度大小顺序为________________________________.
(2) (NH4)2SO4溶液中离子浓度大小顺序为________________________________.
(3) Na2CO3溶液中离子浓度大小顺序为________________________________.
3配制盐溶液时,加酸或碱抑制水解:
为了防止配制FeCl3溶液时可能浑浊,应向溶液中加入________抑制______水解
4把盐溶液蒸干制取无水盐晶体:把下列盐溶液蒸干得到何种物质:
AlCl3_______ Al2(SO4)3 ________ FeCl3________ Na2CO3_______ CuSO4 _____
5判断溶液中的离子能否共存:主要掌握Al3+(Fe3+)与HCO3-、CO32- ,AlO2-、S2-不共存。
6某些活泼金属与盐溶液的反应:Mg粉投入NH4Cl溶液中反应的离子方程式:
______________________________________________
7试剂存放:盛放Na2CO3溶液的试剂瓶不能用玻璃塞,原因是
____________________________________________________
盛放NH4F溶液不能用玻璃瓶,是因为_______________________________________
8日常生活中的应用:
(1)泡沫灭火器原理(方程式)_______________________________
(2)为什么,KAl(SO4)2 ,Fe2(SO4)3、Al2(SO4)3等盐可用做净水剂
__________________________________
(3)草木灰为什么不能和铵态氮肥混合使用
_______________________________________.
1盐类水解的实质_________________________________________________________
注意以下几点:1能发生水解反应的盐,必须是含有弱根离子(弱碱阳离子或弱酸根离子)的可溶性盐。如__________________________
2盐类水解过程就是水的电离平衡移动过程,也就是说,盐类的水解能促进水的电离。使水的电离度增大。即在常温下,可水解盐溶液中由水电离出的c(OH_)___10-7mol/L.(>、<、=)
3盐类水解反应生成酸和碱,所以盐类水解反应可看着是中和反应的逆反应。
2盐类水解的类型和规律
1强碱弱酸盐水解,溶液呈_____性,PH____7。如CH3COONa、______、______等。原因是_______与水电离出的___结合生成_______.从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-) c(H+),溶液呈 性。
写出下列盐水解的离子方程式:
CH3COONa
K2CO3
2强酸弱碱盐水解,溶液呈_____性,PH____7。如NH4Cl、______、______等。原因是_______与水电离出的___结合生成_______.从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-) c(H+),溶液呈 性。
写出下列盐水解的离子方程式:
FeCl3
NH4Cl
3强酸强碱盐不发生水解,溶液呈_____性,PH____7。
4弱酸弱碱盐强烈水解,溶液的酸碱性取决于形成盐的酸和碱的相对强弱。
5弱酸酸式盐的水解。溶液液的酸碱性取决于酸式根离子的电离程度和水解程度的相对大小。若电离程度_____水解程度,则溶液呈酸性。如NaHSO3、NaH2PO4等。若电离程度______水解程度,则溶液呈碱性。如NaHCO3Na2HPO4等
水解规律:“谁弱谁水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性。”
针对性练习:
(1)用_______可鉴别NH4Cl、NaCl、CH3COONa三种溶液。
(2)相同浓度的Na2CO3、NaHCO3、CH3COONa溶液的PH大小顺序为___________________
(3)相同浓度拓NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则对应三种酸的酸性强弱顺序为________________________.
3影响盐类水解的因素
1盐类本身原性质:这是影响盐类水解的主要因素。组成盐的酸或碱越弱,其水解程度越大,溶液的碱性或酸性越强。
2温度:盐的水解是_____热反应。因此升高温度其水解程度_____.
3浓度:盐的浓度越小,其水解程度越______.
4溶液原酸碱性:控制溶液的酸碱性,可以促进或抑制盐的水解。如Na2CO3溶液中加碱可以_____水解。加酸可以_____水解。
针对性练习:(1)水解反应:Fe3++3H2O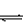 Fe(OH)3+3H+
Fe(OH)3+3H+
|
条件 |
平衡移动方向 |
Fe3+的水解程度 |
PH |
|
|
浓度 |
加FeCl3 |
|
|
|
|
加水 |
|
|
|
|
|
温度升高 |
|
|
|
|
|
加HCl |
|
|
|
|
|
加少量的NaOH |
|
|
|
|
|
加Na2CO3 |
|
|
|
(2)为什么热的纯碱溶液去污效果好?
(3)能使Na2CO3溶液中Na+与CO32- 更接近2:1的措施是
A 加水 B 加Na2CO3粉末 C 加KOH固体 D 加热
(一)本课预习题:
1、下面关于玻尔原子理论的观念解释不正确的是:
A、原子只能处于一系列不连续的状态之中,每个状态都对应一定的能量;
B、原子中,虽然电子在不断的做加速运动,但只要能量状态不改变,就不会向外辐射能量;
C、原子从一种定态跃迁到另一种定态时,一定要辐射出一定频率的光子;
D、原子的每一个能量状态都对应有一个电子轨道,并且这些轨道是不连续的。
2、根据玻尔的原子理论,原子中的电子绕核运动的半径:
A、可以取任意值;
B、可以在某一范围内任意取值;
C、可以取一系列不连续的任意值;
D、是一系列不连续的饿特定值。
3、根据玻尔理论,氢原子中,量子数n越大,则以下说法中正确的是:
A、电子轨道半径越大;
B、核外电子的速率越大;
C、氢原子能级的能量越大;
D、核外电子的电势能越大。
4、对α粒子散射实验装置描述正确的是:
A、实验器材有:放射源、金箔、荧光屏、显微镜;
B、金箔的厚度对实验结果无影响;
C、如果不用金箔而用铝箔就不能发生散射现象;
D、实验装置放在空气中和真空中都可以。
5、α粒子散射实验结果是:
A、只有一小部分α粒子穿过金箔而没有明显的偏转;
B、大多数α粒子的偏转角超过900,极少数达到1800;
C、偏转角最大的也没有超过900;
D、绝大多数α粒子穿过金箔后,没有产生显著的偏转。
(五)正确理解卢瑟福的原子核式结构与玻尔原子模型的关系:
卢瑟福通过α粒子散射实验建立了原子的核式结构学说,却与经典的电磁理论发生了矛盾。按照经典的电磁理论,电子绕核旋转是有加速度的(作圆周运动的物体有向心加速度),它要辐射电磁波,因而能量逐渐减小(电磁波是一种物质具有能量),最后电子将落到原子核上,这样原子就不可能是稳定的,这与实际情况不符。另外按照经典的电磁理论,大量原子发光的光谱是包含一切频率的连续光谱,这也与原子光谱的实际情况不符。
针对上述矛盾,玻尔认为从宏观的现象总结出来的电磁理论不能应用于原子这样小的物体产生的微观现象,而提出了玻尔的原子理论,它的核心是量子化(即不连续变化)
玻尔理论的成功之处在于它引入了量子观念,这是宏观领域里没有的,解决了上述两个矛盾(即原子的稳定性及辐射频率问题),因而圆满的解释了氢光谱的规律。但失败之处就在于仍然保留了过多的经典的物理理论,比如保留了电子在一定轨道上绕核做匀速圆周运动这种经典力学的概念;因而玻尔理论不能解释其它原子的光谱规律,它的出路就在于彻底与宏观理论决裂,建立真正适用于微观世界的理论。
[例题2]下列对原子结构的认识中,正确的是:
A、原子中绝大部分是空的,原子核很小;
B、原子的全部正电荷和全部的质量都集中在原子核上;
C、电子在核外旋转,原子核对电子的库仑力提供向心力;
D、原子核的半径大约为1×10-10m 。
[分析与解答]选A、C
1、卢瑟福类比了行星运动模型,提出原子的核式结构模型,电子绕核运转所需的向心力由核对它的引力来提供。
2、既然核外还有电子,便不能说原子“全部质量”集中在原子核。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com