
1. 集合P={x| x2-16<0}, Q={x| x=2n, n∈Z}, 则P∩Q 等于 A. {-2 , 0 , 2 } B. {-2 , 2 } C.{-2 , 2,-4 , 4 } D. {-2 , 2 , 0,-4 , 4 }
20. (1) NaOH水溶液加热; 消去。
(2) A 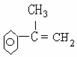 ; F
; F 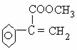 。
。
(3) 
19.(1)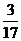 (或18%), 增大 , 减小 .
(或18%), 增大 , 减小 .
(2) 8NH3+6NO2 7N2+12H2O
。
7N2+12H2O
。
18.
(1) Fe2O3+3CO 2Fe+3CO2(把Fe2O3换成Fe3O4或FexOy也行;
(2) 3Fe+4H2O
2Fe+3CO2(把Fe2O3换成Fe3O4或FexOy也行;
(2) 3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(3) O2+4e-+2H2O=4OH- , 4Fe(OH)2+O2+2H2O=4Fe(OH)3 。
(4) 正极 , Cu2++2e-=Cu 。
17. (1) 第二周期 VA 。 H3PO4>H2AsO4
(2) > 。 (3) SO2+Br2+2H2O=4H++SO42-+2Br- 。
16.(每空3分,共12分)
(1) 浓度 , ③②① .
(2) 温度 , H2C2O4不足 .
21. 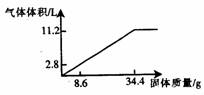 (8分)在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答:
(1)写出反应的离子方程式:
(2)NaOH溶液的物质的量浓度是
mol/L.
(3)当NaOH溶液为140ml,固体为51.6 g时,充分反应后产生气体为 mol.
(4)当NaOH溶液为180ml,固体仍为51.6g时,充分反应后产生气体
为 mol.
(8分)在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答:
(1)写出反应的离子方程式:
(2)NaOH溶液的物质的量浓度是
mol/L.
(3)当NaOH溶液为140ml,固体为51.6 g时,充分反应后产生气体为 mol.
(4)当NaOH溶液为180ml,固体仍为51.6g时,充分反应后产生气体
为 mol.
 H2O2(H2O) , MnO2
(Na2O2) , 2H2O2
H2O2(H2O) , MnO2
(Na2O2) , 2H2O2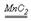 2H2O+O2↑ (2Na2O2+2H2O=4NaOH+O2↑) ,
Na , 2CH2CH2OH+2Na=2CH3CH2ONa+H2↑
。
2H2O+O2↑ (2Na2O2+2H2O=4NaOH+O2↑) ,
Na , 2CH2CH2OH+2Na=2CH3CH2ONa+H2↑
。
20. (8分)某芳香烃A有如下转化关系,其中 M 是一种重要的有机合成的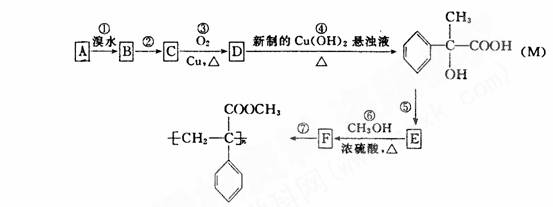 按要求填空:
(l)写出反应 ② 的反应条件:
;反应 ⑤ 的反应类型: 。
(2)写出 A 和 F 的结构简式: A ,
F
。
(3)写出反应 ⑥ 的化学方程式:
。
按要求填空:
(l)写出反应 ② 的反应条件:
;反应 ⑤ 的反应类型: 。
(2)写出 A 和 F 的结构简式: A ,
F
。
(3)写出反应 ⑥ 的化学方程式:
。
19.  (8分)哈伯因发明了由氮气和氢气合成氨气的方法而获得 1918 年诺贝尔化学奖。其反应的化学方程式为N2 +3H2
2NH3,在298K时:ΔH=-92.2kJ·mol-1.
(1)在500℃下,合成塔中反应开始时氮气、氢气的浓度分别为1mol·L-1、3mol·L-1, 平衡时氢气的转化率为30% ,则平衡时氨气的体积分数为
;此时将温度升高至 600℃,逆反应速率增大,正反应速率 (填“增大”、“减小”或“不变”,下同),达到新平衡时氢气的转化率
.
(2)在硝酸生产过程中所排放出来的气体含有 NO2会污染环境,现用氨催化还原法将 NO2转化为无毒气体直接排入空气中,写出有关反应的化学方程式:
。
(8分)哈伯因发明了由氮气和氢气合成氨气的方法而获得 1918 年诺贝尔化学奖。其反应的化学方程式为N2 +3H2
2NH3,在298K时:ΔH=-92.2kJ·mol-1.
(1)在500℃下,合成塔中反应开始时氮气、氢气的浓度分别为1mol·L-1、3mol·L-1, 平衡时氢气的转化率为30% ,则平衡时氨气的体积分数为
;此时将温度升高至 600℃,逆反应速率增大,正反应速率 (填“增大”、“减小”或“不变”,下同),达到新平衡时氢气的转化率
.
(2)在硝酸生产过程中所排放出来的气体含有 NO2会污染环境,现用氨催化还原法将 NO2转化为无毒气体直接排入空气中,写出有关反应的化学方程式:
。
18. (12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。 (l)写出工业上高炉炼铁的化学方程式: 。 (2)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是可燃性气体,则其反应的化学方程式为 。 (3)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。 ① 原电池反应: 负极:2Fe-4e-=2Fe2+、正极: ② 氢氧化物的形成: Fe2 + + 2OH-= Fe(OH)2 ↓、 ③ 氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。 (4)为了防止铁生锈,可在铁制品表面镀上一层铜(如右图装置),则直流电源a端是 (填“正极”或“负极”),铁制品表面发生的电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com